
 +H≡C-H→
+H≡C-H→ =C+H,回答下列问题:
=C+H,回答下列问题: ,A的名称为乙苯.
,A的名称为乙苯. .
. 的合成路线:
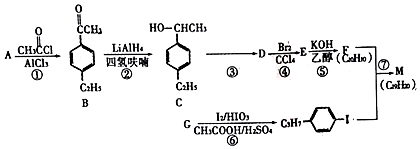
的合成路线:分析 由B的结构可知反应①为取代反应,A为 ,B发生还原反应生成C,D能与溴的四氯化碳反应生成E,E在氢氧化钾、乙醇条件下反应得到F,可知E为卤代烃,D含有不饱和键,故反应③为消去反应,则D为
,B发生还原反应生成C,D能与溴的四氯化碳反应生成E,E在氢氧化钾、乙醇条件下反应得到F,可知E为卤代烃,D含有不饱和键,故反应③为消去反应,则D为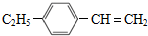 ,E为
,E为 ,F为
,F为 ,由M的分子式可知,反应⑦属于取代反应,M的结构简式为
,由M的分子式可知,反应⑦属于取代反应,M的结构简式为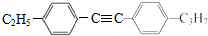 .
.
(6)中苯乙烯与溴发生加成反应得到 ,再在KOH/乙醇条件下发生消去反应生成
,再在KOH/乙醇条件下发生消去反应生成 ,甲苯通过I2/HIO3、CH3COOH/H2SO4得到
,甲苯通过I2/HIO3、CH3COOH/H2SO4得到 ,
, 与
与 发生取代反应得到
发生取代反应得到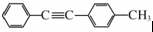 ,以此解答该题.
,以此解答该题.
解答 解:(1)由以上分析可知M的结构简式为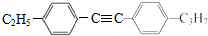 ,A为
,A为 ,为乙苯,
,为乙苯,
故答案为: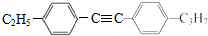 ;乙苯;
;乙苯;
(2)D为 ,含有的官能团为碳碳双键,故答案为:碳碳双键;
,含有的官能团为碳碳双键,故答案为:碳碳双键;
(3)由官能团的变化可知②的反应类型是加成反应,⑥的反应类型是取代反应,
故答案为:加成反应;取代反应;
(4))⑤的化学方程式为: ,
,
故答案为: ;
;
(5)B(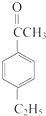 )的同分异构体中能同时满足如下条件:①能与氯化铁溶液发生显色反应;②苯环上只有两个取代基;③除苯环以外没有其它环状结构,含有-HO,2个侧链为-OH、-C4H7,-C4H5有8种同分异构体,
)的同分异构体中能同时满足如下条件:①能与氯化铁溶液发生显色反应;②苯环上只有两个取代基;③除苯环以外没有其它环状结构,含有-HO,2个侧链为-OH、-C4H7,-C4H5有8种同分异构体,
或各有邻、间、对3种,共有24种,
故答案为:24;
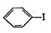
(6)苯乙烯与溴发生加成反应得到 ,再在KOH/乙醇条件下发生消去反应生成
,再在KOH/乙醇条件下发生消去反应生成 ,甲苯通过I2/HIO3、CH3COOH/H2SO4得到
,甲苯通过I2/HIO3、CH3COOH/H2SO4得到 ,
, 与
与 发生取代反应得到
发生取代反应得到 ,合成合成路线流程图为:
,合成合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,为高考常见题型,侧重考查有机物的结构与性质、有机反应类型、限制条件同分异构体书写等,注意根据有机物的结构与反应条件进行推断,侧重考查学生分析推理能力、知识迁移运用能力,难度中等.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO中有少量的NO2:用水洗涤后再干燥 | |
| B. | 食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干 | |
| C. | O2中有少量的CO:通过灼热的氧化铜 | |
| D. | NO2中有少量NH3:用水洗涤后干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1 LpH=l的硫酸溶液中,含有H+的数目为0.2NA | |
| B. | 1 mol Na2O2与水完全反应时转移电子数目为2 NA | |
| C. | 向含1 mol Cl-的NH4Cl溶液中加入氨水使溶液呈中性,此时溶液中NH4+数目为NA | |
| D. | 向2 mL0.5 mol/L硅酸钠溶液中滴入过量盐酸制硅酸胶体,所得胶粒数目为0.001 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| B. | 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA | |
| C. | 1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价健数均为4NA | |
| D. | 工业上电解饱和氯化钠溶液,得到标准状况下22.4L氢气时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
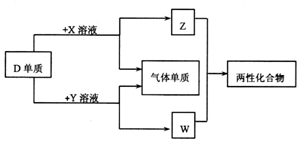 A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期.X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示.下列说法中正确的是( )
A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期.X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示.下列说法中正确的是( )| A. | 离子半径:C+>D3+>B2- | |
| B. | C的单质的熔点低于D的单质的熔点 | |
| C. | 电解C、E形成的化合物水溶液可生成C、E对应的单质 | |
| D. | 由A、B、E形成的化合物都含有共价键,溶液都呈强酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +46 kJ/mol | B. | +92kJ/mol | C. | -46 kJ/mol | D. | -92 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(NaOH) | B. | NaCl(HCl) | C. | CuCl2 (CuO) | D. | H2SO4 (H2SO4 ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com