
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 根据A的相对分子质量和各元素的质量分数确定其分子式,然后结合A的性质确定其含有官能团,然后结合同分异构体的书写原则判断满足体积的有机物种类.
解答 解:A的相对分子质量为118,其中C的质量分数为41%,H为5%,O为54%,则A分子中含有C、H、O的数目分别为:N(C)=$\frac{118×41%}{12}$≈4、N(H)=$\frac{118×5%}{1}$≈6、N(O)=$\frac{118×54%}{16}$≈4,其分子式为C4H6O4,
化合物A能与碳酸氢钠溶液反应放出气体,数目其分子中含有-COOH;也能与新制氢氧化铜悬浊液反应生成砖红色沉淀,数目分子中含有官能团-CHO;还必须是醇羟基,则满足条件的有机物结构满足:含有①1个-COOH、②1个-CHO和③1个-OH,还剩余2个饱和C,相当于将3种官能团添加到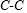 上,添加方式有:三种官能团在同一个碳原子上,或其中两种官能团共C,另一种官能团在另一个碳原子上,第一种情况有1种,第二种情况有3种,总共有4种结构,
上,添加方式有:三种官能团在同一个碳原子上,或其中两种官能团共C,另一种官能团在另一个碳原子上,第一种情况有1种,第二种情况有3种,总共有4种结构,
故选C.
点评 本题考查同分异构体的判断,题目难度中等,明确常见有机物组成、结构与性质为解答关键,注意掌握同分异构体的概念及书写原则,试题培养了学生的分析能力及逻辑推理能力.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 达平衡后降低温度,混合气体平均相对分子质量减小 | |
| B. | 使用催化剂能加快反应速率,缩短达平衡所需的时间且提高A2的转化率 | |
| C. | 达平衡后升高温度并增大压强,有可能每一组分的百分含量都不改变,但平衡常数一定发生改变 | |
| D. | 达平衡后,降低温度或减小压强都有利于该平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2升华 | |
| B. | NaCl颗粒被粉碎 | |
| C. | 乙醇溶于水 | |
| D. | NH4HCO3加热分解时可以闻到刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| B. | 元素周期表共七个横行代表七个周期,18 个纵横代表18 个族 | |
| C. | 主、副族元素的族序数从左到右都是依次由小到大排列(如ⅠB→→ⅦB) | |
| D. | 除零族外,由长、短周期元素共同组成的元素族称为主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.
(1)氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com