
| A. | 颜色不同 | B. | 都能使滴有酚酞的NaOH溶液褪色 | ||
| C. | 都能使有色布条褪色 | D. | 加AgNO3溶液都能生成白色沉淀 |
科目:高中化学 来源: 题型:填空题
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol的Ba2+ | B. | 0.5mol的H+ | C. | 1.0mol的H+ | D. | 2.0mol的OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
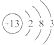 ,下列关于该元素的说法中,错误的是( )
,下列关于该元素的说法中,错误的是( )| A. | 它的阳离子带3个单位正电荷 | B. | 它是一种金属元素 | ||
| C. | 它的阳离子有10个质子 | D. | 其原子核外有13个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4、C6H6 | B. | CH4、CH2O | C. | C3H8、CH3CH2OH | D. | C2H6、CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
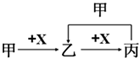
| A. | 甲为C,X为O2 | B. | 甲为Fe,X为Cl2 | ||
| C. | 甲为SO2,X为NaOH溶液 | D. | 甲为Fe,X为稀硝酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 | |
| B. | 将氢氧化钠溶液和氨水各稀释一倍,两者的c(OH-)均减少到原来的一半 | |
| C. | 常温下,某溶液中由水电离出的c(OH-)=1×10-10 mol/L,该溶液可能是盐酸 | |
| D. | 如果盐酸的物质的量浓度是醋酸的两倍,则盐酸的c(H+)也是醋酸的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高高锰酸钾的氧化能力,用浓盐酸酸化 | |
| B. | 抑制Fe2+ 的水解,用稀硝酸酸化 | |
| C. | 检验某卤代烃中是否含氯元素,先加HNO3酸化,再加AgNO3溶液检验. | |
| D. | 确认溶液中含有SO42- 时,先用过量盐酸酸化,再加BaCl2溶液检验. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com