


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、① | B、②④ | C、③④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,2.8g N2与C2H4的混合气体所含电子数为1.4 NA |
| B、标准状况下,1.12 L NO与1.12O2的混合物中含有的原子数为0.2NA |
| C、25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA |
| D、常温下,1 L 0.1 mol?L-1的NH4NO3溶液中氧原子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
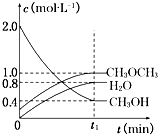 (1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)?N2O3(g),其平衡常数表达式为K=
(1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)?N2O3(g),其平衡常数表达式为K=查看答案和解析>>
科目:高中化学 来源: 题型:
 室温下,单质A、B、C分别为银白色固体、黄绿色气体、无色气体,且A在空气中燃烧会变成淡黄色粉末.在合适的反应条件下,它们可以按下面框图进行反应,且E溶液是无色的.请据图回答:
室温下,单质A、B、C分别为银白色固体、黄绿色气体、无色气体,且A在空气中燃烧会变成淡黄色粉末.在合适的反应条件下,它们可以按下面框图进行反应,且E溶液是无色的.请据图回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
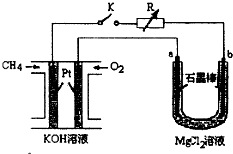 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 CH4和 O2,电解质为 KOH 溶液.某研究小组将甲烷燃料电 池作为电源进行氯化镁溶液龟解实验,电解装置如图所示.
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 CH4和 O2,电解质为 KOH 溶液.某研究小组将甲烷燃料电 池作为电源进行氯化镁溶液龟解实验,电解装置如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com