
(11分)一定质量的镁、铝混合物投到2 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入2 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
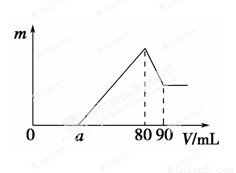
(1)80~90ml对应反应的离子方程式 。
(2)金属铝的质量为______ _
(3)盐酸的体积是 ml。
(4)a的取值范围是___ __。
(5)n(Mg)/n(Al)的最大值是 。
(1)Al(OH)3+ OH-=AlO2-+2H2O (2)0.54g
(3)80 (4)0≤a<50 (5)2.5
【解析】
试题分析:
(1)根据图可知,首先发生的反应是中和过量的酸:H++OH-=H2O,然后是沉淀两种金属离子:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,最后是Al(OH)3的溶【解析】
Al(OH)3+ OH-=AlO2-+2H2O,即80~90ml对应反应的离子方程式为Al(OH)3+ OH-=AlO2-+2H2O;
(2)从横坐标80mL到90mL这段可以求出n(Al(OH)3)=n(OH-)=2 mol·L-1×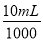 =0.02mol,则n(Al)=n(Al(OH)3)=0.02mol,即为0.54g;
=0.02mol,则n(Al)=n(Al(OH)3)=0.02mol,即为0.54g;
(3)镁、铝混合物投到盐酸中,生成氯化镁和氯化铝,并且从图上可知盐酸过量,当加入氢氧化钠溶液后,氢氧化钠先与过量的酸反应生成氯化钠,后氢氧化钠又与氯化镁和氯化铝反应生成氯化钠,当氢氧化钠溶液的体积为80mL时,盐酸中的氯离子都与钠离子结合成氯化钠,根据原子守恒可知,n(HCl)=n(NaOH)=2 mol·L-1×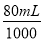 ,则盐酸的体积为V=
,则盐酸的体积为V=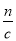 =80mL;
=80mL;
(4)假设盐酸溶解金属后不剩,这种情况下,酸恰好与合金反应完全,即a=0,通过极值法,当合金中完全是铝时,因为沉淀Al3+需要NaOH溶液的体积为30mL,从图可知,中和过量的酸所消耗的碱液体积最大为50mL,但是假设不成立,最大值是不存在的,所以的取值范围为 0≤a<50;
(5)n(Al)=n(Al(OH)3)=2molL-1×0.01L=0.02mol,所以沉淀Al3+需要的OH-为0.06mol,即NaOH溶液的体积为30mL,镁离子和铝离子沉淀完全消耗的碱的体积为80-a,若假设盐酸不剩,所以沉淀Mg2+需要NaOH溶液的体积最大值为50mL,求出n(Mg)的最大值为0.05mol,所以该合金中镁铝两元素物质的量之比的最大值为0.05mol:0.02mol=2.5。
考点:考查镁、铝的化学性质及计算
点评:本题考查了镁、铝的化学性质及计算,难度中等。解题时要注意根据镁铝的化学性质结合图像中的数量关系解答。(4)(5)两问可以采用假设法求极值。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015广东省揭阳市高二上学期期末考试化学理试卷(解析版) 题型:选择题
反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示,下列说法正确的是
C(g) +D(g)过程中的能量变化如图所示,下列说法正确的是
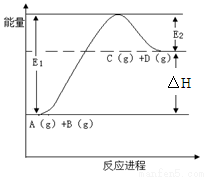
A.该反应是放热反应
B.加入催化剂后,反应加快,△H减小
C.反应物的总键能大于生成物的总键能
D.反应达到平衡时,升高温度,A的转化率增大
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市东城区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列物质所属类别不正确的是
A.纯碱——碱 B.氯化铝——盐
C.金属钠——还原剂 D.二氧化硅——酸性氧化物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高二12月月考化学试卷(解析版) 题型:选择题
用惰性电极电解饱和Na2CO3溶液,若保持温度不变,则一段时间后
A.溶液的pH变大 B.c(Na+)与c(CO32-)的比值变大
C.溶液浓度变大,有晶体析出 D.溶液浓度不变,有晶体析出
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高二12月月考化学试卷(解析版) 题型:选择题
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 B.2Fe+2H2O+O2=2Fe(OH)2
C.2H2O+O2+4e-=4OH- D.Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源:2014-2015重庆市高一上学期第三次月考化学试卷(解析版) 题型:选择题
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。右边图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是

查看答案和解析>>
科目:高中化学 来源:2014-2015重庆市高一上学期第三次月考化学试卷(解析版) 题型:选择题
常温下,在水溶液中发生如下反应
①16H++10C-+2XO4 - = 2X2++5C2+8H2O;②2A2++B2 = 2A3++2B-;③2B-+C2 = B2+2C-。下列说法错误的
A.反应C2 + 2A2+ = 2A3+ + 2C- 可以进行
B.还原性由强到弱的顺序是C->A2+>B->X2+
C.氧化性由强到弱的顺序是XO4- >C2>B2>A3+
D.反应③是置换反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高二上学期第三次月考化学试卷(解析版) 题型:实验题
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数数值,其实验方案的要点为:①用直流电源电解CuCl2溶液,所用仪器如下图所示。②在电流强度为I A,通电时间为t min后,精确测得电极上析出铜的质量为m g。

试回答:(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示):
E接 ,C接 , 接F。
(2)写出B电极上发生的电极反应式: ;
G试管中淀粉KI溶液变化的现象为 ,
相应的离子方程式是 。
(3)为精确测定电极上析出的铜的质量,所必需的实验步骤的先后顺序应是 。(选填下列操作步骤的编号)
①称量电解前电极质量 ②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后的电极 ④低温烘干电极后称量
⑤低温烘干刮下的铜后称量 ⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿伏加德罗常数的计算式:NA= 。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省泰安市高二上学期期末统考高二化学试卷(解析版) 题型:填空题
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢材年产量的四分之一。
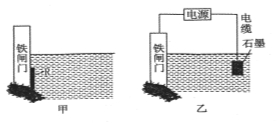
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为________________
(2)为了降低某铁闸门被腐蚀的速率,可以采用上述图甲所示的方案,其中焊接在铁闸门上的固定材料R可以采用____(填序号)。
A.铜 B.钠 C.锌 D.石墨
(3)上图乙所示的方案也可以降抵铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的_______极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com