
向30 mL 1 mol·L-1的AlCl3溶液中逐渐加入浓度为4 mol·L-1的NaOH溶液,若产生
0.78 g白色沉淀,则加入的NaOH溶液的体积可能为 ( )
A.3 mL B.7.5 mL
C.15 mL D.17.5 mL
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
四种短周期元素A、B、C、D的原子序数依次递增.其中A、B、C二种元素基态原子的2p能级上都有未成对电子.且未成对电子个数分别是2、3、2;D与C 可以形成D2C和D2C2两种化合物。回答下列问题:
(1)已知A元素与氢元素形成的某种气态化合物在标准状况下的密度为1.1 6 1 g·L-1,则在该化合物的分子中A原子的杂化方式为 。
(2)A、B、C二种元素的第一电离能由小到大的顺序为 (填元素符号)。
 (3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子
所需要的能量称为第二电离能I2,依次还有I3、I4、I5……,推测D元素
的电离能第一次突增应出现在第 电离能。
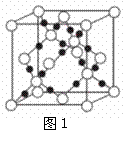
(4)AC2在高温高压下所形成的晶体其晶胞如图1所示。
该晶体的类型属于 晶体.该品体中A原子轨道的
杂化类型为 。
(5)A和C形成原子个数比为1:3的常见离子.推测这种微粒的空间
 构型为 。
构型为 。
(6)C和D形成的一种离子化合物D2C的晶胞结构如图2所示.该晶体
中阳离子的配位数为 。距一个阴离子周围最近的所有阳离子为顶点
构成的几何体为 。已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA.
则晶胞边长a= cm(用含ρ、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)
(1) 的名称是
的名称是
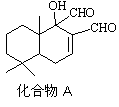
(2)写出右图化合物A中含氧官能团的名称
(3)某物质的实验式是Co(NH3)5BrSO4,向它的溶液中加入BaCl2溶液时,无明显现象;加入强碱处理,也无气体放出。若加入 AgNO3溶液时,产生淡黄色沉淀。写出它的配位化学式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的无色溶液,不用其他试剂即可鉴别的是________。
①NaOH、AlCl3 ②NaHCO3、H2SO4 ③Na[Al(OH)4]、NaHSO4 ④Na2CO3、HCl ⑤Na2CO3、NaHCO3、Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是 ( )
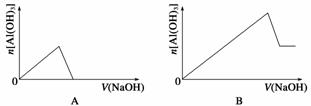

查看答案和解析>>
科目:高中化学 来源: 题型:
有一块镁铝合金,其中镁与铝的质量比是8∶9。加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是
( )
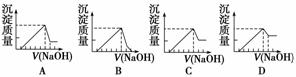
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
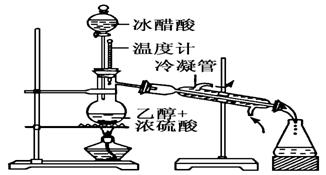
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其中浓硫酸作用的是______________________________________
(2)在该实验中,若用1 mol乙醇和1 mol乙酸在浓硫酸作用下加热,充分反应,能否生成1 mol乙酸乙酯?________(填能、否)
(3)写出乙酸与小苏打溶液反应的离子方程式______________________________
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
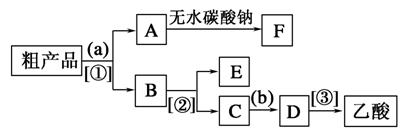
试剂a是__________ ,分离方法②是________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com