
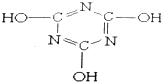
| A. | 分子式为C3H3N303 | B. | 属于共价化合物 | ||
| C. | 分子中只含极性键,不含非极性键 | D. | 该分子中的C原子采取sp3杂化 |
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| B. | 动物皮革的主要成分是蛋白质,且天然蛋白质水解的最终产物是氨基酸 | |
| C. | 苯和乙烯都可以与溴的四氯化碳溶液反应而使之褪色 | |
| D. | 石油分馏可获得乙酸,苯及其衍生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
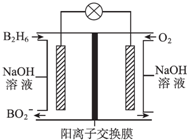 乙硼烷(B2H6)碱性燃料电池是一种新型电池,具有能量转化效率高、无污染等优点,其结构示意图如图所示.下列说法中不正确的是( )
乙硼烷(B2H6)碱性燃料电池是一种新型电池,具有能量转化效率高、无污染等优点,其结构示意图如图所示.下列说法中不正确的是( )| A. | 正极的电极反应式为O2+4e-+2H2O═4OH- | |
| B. | 电池工作时,Na+通过阳离子交换膜向右移动 | |
| C. | 转移6mol电子理论上消耗乙硼烷的质量为14g | |
| D. | 消耗1mol B2H6时负极参与反应的n(OH-)为12mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
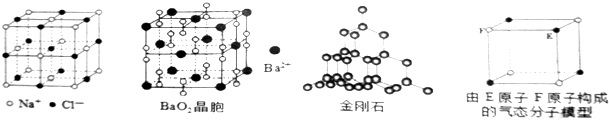
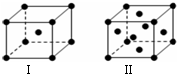
| A. | 在NaCI晶体中,距Na+最近的Cl-有6个 | |
| B. | 在BaO2晶胞中,每个晶胞平均占有4个Ba2+和4个022- | |
| C. | 在金刚石晶体中,碳原子与碳碳键的个数比为1:2 | |
| D. | 该气态分子的分子式为EF或FE |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,向20ml浓度为0.lmol/L的CH3COOH溶液中逐滴加入0.lmol/L的NaOH溶液,溶液pH的变化如图所示,下列说法不正确的是( )
25℃时,向20ml浓度为0.lmol/L的CH3COOH溶液中逐滴加入0.lmol/L的NaOH溶液,溶液pH的变化如图所示,下列说法不正确的是( )| A. | c点时,c(Na+)=c(CH3COO-) | |
| B. | b点时,c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | d点时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 从a点到c点间可能有:c(CH3COO-)>c(H+)=c(Na+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
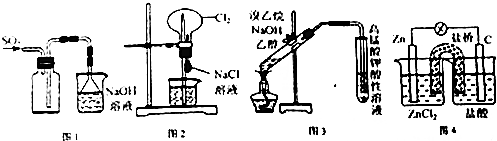
| A. | 用图1装置可以收集SO2 | |
| B. | 用图2装置可以完成“喷泉”实验 | |
| C. | 用图3装置可以检验溴乙烷与NaOH醇溶液共热产生的乙烯 | |
| D. | 用图4装置可以实现化学反应:Zn+2H+═Zn2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2. ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③$\sqrt{2}$、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③$\sqrt{2}$、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com