
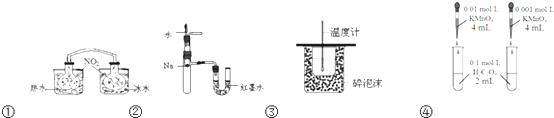
| A、装置①依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 |
| B、装置②依据U管两边液面的高低判断Na和水反应的热效应 |
| C、装置③测定中和热 |
| D、装置④依据褪色快慢比较浓度对反应速率的影响 |


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 | |
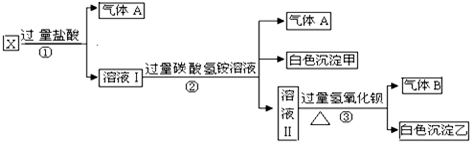
| 步骤1 | 将上述混合液B分置于试管1、试管2中. | |
| 步骤2 | 往试管1中滴加 | |
| 步骤3 | 往试管2中滴加 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们单质的熔、沸点随核电荷数的增加逐渐升高 |
| B、它们单质的颜色随核电荷数的增加逐渐加深 |
| C、它们单质的密度随核电荷数的增加逐渐增大 |
| D、它们氢化物的稳定性核电荷数的增加逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用蒸馏的方法制取蒸馏水 |
| B、用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
| C、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| D、粗盐提纯中用加热、蒸发的方法可以除去CaCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在空气中金属铝表面迅速氧化形成保护层 |
| B、镀锌铁面有划损时,仍然能阻止铁被氧化 |
| C、红热的铁丝与冷水接触,表面形成蓝黑色保护层 |
| D、锌与稀硫酸反应时,加入少量CuSO4溶液可使反应加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com