
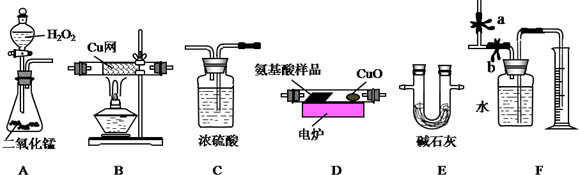
分析 根据题意可知,用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成,用双氧水产生氧气,用纯氧气将CxHyOzNp氧化成二氧化碳、水和氮气,用氧化铜将未完全氧化的碳元素氧化成二氧化碳,用浓硫酸吸收水,用碱石灰吸收二氧化碳,用铜网吸收未反应的氧气,用排水量气法测得氮气的体积,为了准确测得各成分的质量,实验开始先用氧气将装置中的空气排尽,同时应按先吸收水,再吸收二氧化碳,再除氧气,最后测氮气的体积,根据元素守恒可计算出CxHyOzNp的组成,据此答题;
解答 解:根据题意可知,用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成,用双氧水产生氧气,用纯氧气将CxHyOzNp氧化成二氧化碳、水和氮气,用氧化铜将未完全氧化的碳元素氧化成二氧化碳,用浓硫酸吸收水,用碱石灰吸收二氧化碳,用铜网吸收未反应的氧气,用排水量气法测得氮气的体积,为了准确测得各成分的质量,实验开始先用氧气将装置中的空气排尽,同时应按先吸收水,再吸收二氧化碳,再除氧气,最后测氮气的体积,根据元素守恒可计算出CxHyOzNp的组成,
(1)根据上面的分析可知,该实验装置的合理连接顺序为:A、C、D、C、E、B(或B、E)、F,
故答案为:DCEB或DCBE;
(2)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是将装置内的N2(或空气)排除干净,
故答案为:将装置内的N2(或空气)排除干净;
(3)燃烧管D中放入CuO的作用是将未充分燃烧的产物CO转化为CO2 (或使氨基酸中的碳完全转化为CO2),装置B的作用是 除去多余的O2,保证F装置最终收集的气体全为N2,
故答案为:将未充分燃烧的产物CO转化为CO2 (或使氨基酸中的碳完全转化为CO2); 除去多余的O2,保证F装置最终收集的气体全为N2;
(4)根据上面的分析可知,为了确定此氨基酸的分子式,除了准确测量N2的体积外,还需得到氨基酸的摩尔质量、生成二氧化碳气体的质量、生成水的质量,故选ABC;
(5)在读取F装置中所排水的体积时,液面左低右高,则所测气体的压强大于空气中的压强,所以测得的体积偏小,
故答案为:偏小;
(6)根据分子式为C2H4O2,及氨基酸中的官能团可知,该分子中有羧基,实验证明该官能团的方法为取该有机物少许于试管中,滴加NaHCO3溶液,有气泡产生,
故答案为:取该有机物少许于试管中,滴加NaHCO3溶液,有气泡产生.
点评 本题考查学生利用燃烧法确定有机物分子组成的知识,涉及实验方案设计、根据原子守恒法来解答,难度较大,关键在于理解实验原理.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3含有的分子数NA | |
| B. | 常温常压下,4.4gCO2的物质的量一定为0.1mol | |
| C. | 标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L | |
| D. | 7.8gNa2S和7.8gNa2O2中含有的阴离子数目均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
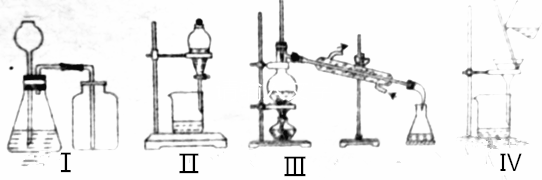
| A. | 选择装置Ⅰ用铜与浓硝酸反应制备NO2 | |
| B. | 选择装置Ⅱ分离乙酸乙酯和饱和碳酸氢钠溶液的混合物 | |
| C. | 选择装置Ⅲ分离对硝酸甲苯和邻硝基甲苯 | |
| D. | 选择装置Ⅳ分离饱和硫代硫酸钠溶液和硫代硫酸钠晶体的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,12gC60和C70的混合物中含有的碳原子数为NA | |
| B. | 22.4L SO2气体中含有的氧原子数为2NA | |
| C. | 1.0L 1.0mol•L-1CH3COOH溶液中含有的CH3COOH分子数为NA | |
| D. | 标准状况下,5.6LCCl4含有的分子数为0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A)=0.5mol/(L•min) | B. | υ(B)=1.2mol/(L•s) | C. | υ(C)=1mol/(L•s) | D. | υ(D)=2mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
| A. | 反应在前50s的平均速率为v(PCl3)=0.0064mol/(L•s) | |
| B. | 保持其它条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入4molPCl3、4molCl2,达到平衡时,则此反应的化学平衡常数为0.025mol/L | |
| D. | 相同温度下,起始时间向容器中充入2molPCl5、0.40molPCl3和0.40molCl2,达到平衡前v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X为负极、Y为正极 | |
| B. | 工作一段时间后,KOH的物质的量不变 | |
| C. | 在标况下通过5.6 L O2完全反应则有l.0 mol 电子发生转移 | |
| D. | 该电池工作时甲烷一极附近溶液 pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其分子的空间构型为三角锥型.
,其分子的空间构型为三角锥型.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com