
| A. | 烷烃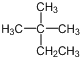 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 甲苯苯环上的一个氢原子被含4个碳原子的烷基取代,所得产物有12种 | |
| C. | 乙烯能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,其原理相同 | |
| D. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
分析 A.该有机物主链为丁烷,说明选取的主链不是最长碳链;
B.先利用等效H判断甲苯苯环上的H原子种类有3种,4个碳原子的烷基存在四种同分异构体,分别为正丁基、异丁基、仲丁基、叔丁基,据此进行计算;
C.乙烯分子中含有碳碳双键,与溴的四氯化碳溶液发生加成反应,能够被酸性高锰酸钾溶液氧化;
D.碱性条件下不会生成乙酸,应该生成乙酸根离子.
解答 解:A. 的主链为丁烷,在2号C含有2个甲基,其正确名称为:2,2-二甲基丁烷,故A错误;
的主链为丁烷,在2号C含有2个甲基,其正确名称为:2,2-二甲基丁烷,故A错误;
B.4个碳原子的烷基存在四种同分异构体,分别为正丁基、异丁基、仲丁基、叔丁基;当为正丁基,甲苯苯环上的H原子种类有3种,所以有3种同分异构体;当为异丁基,甲苯苯环上的H原子种类有3种,所以有3种同分异构体;当为仲丁基,甲苯苯环上的H原子种类有3种,所以有3种同分异构体;当为叔丁基,甲苯苯环上的H原子种类有3种,所以有3种同分异构体,故甲苯苯环上的一个氢原子被含4个碳原子的烷基取代,所得产物有12种,故B正确;
C.乙烯能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,前者发生加成反应,后者发生氧化反应,两个反应的原理不同,故C错误;
D.碱性条件下生成的乙酸与氢氧根离子发生中和反应,所以CH3CO18OC2H5的水解产物是CH3COO-和C2H518OH,不会生成乙酸,故D错误;
故选B.
点评 本题考查了有机物结构与性质,题目难度中等,涉及有机物命名、酯的水解、同分异构体数目的判断、有机物结构与性质等知识,明确常见有机物结构与性质为解答关键,B为易错点,注意掌握同分异构体的书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
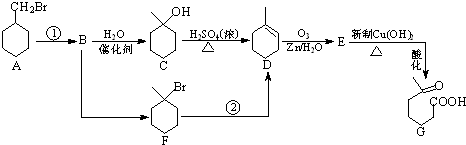
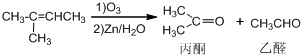
 +NaOH+2Cu(OH)2$\stackrel{△}{→}$
+NaOH+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+3H2O;
+Cu2O↓+3H2O; 物质D与呋喃(
物质D与呋喃(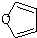 )也可以发生“Diels-Alder反应”,该化学反应方程式为
)也可以发生“Diels-Alder反应”,该化学反应方程式为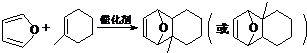 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
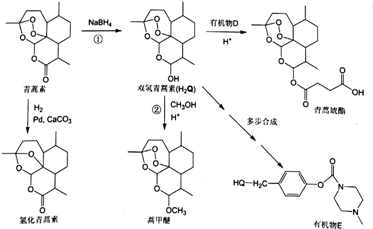
 (或
(或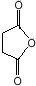 ).
). .
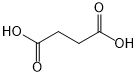
.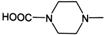 外,还需含苯环的二羟基化合物P,其结构简式为
外,还需含苯环的二羟基化合物P,其结构简式为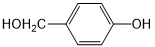 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式
.化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 (或
(或 ,其他合理答案亦可).
,其他合理答案亦可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置甲中铜片表面产生气泡 | |
| B. | 装置甲溶液中SO42ˉ向铜片做定向移动 | |
| C. | 装置乙中电子从铜片经导线流向锌片 | |
| D. | 装置乙中正极的电极反应式:2H++2eˉ═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液,向容量瓶加水至液面离刻度线1~2 cm时,改用胶头滴管定容 | |
| B. | 向某溶液中先加入Ba(NO3)2溶液,再加入足量的HNO3溶液,产生白色沉淀,则该溶液中一定含有SO42- | |
| C. | 分液操作时,将下层液体先放出,然后关闭旋塞,将上层液体从上口倒出 | |
| D. | 将油脂与氢氧化钠溶液混合充分反应后,再加入热的饱和食盐水,则可析出肥皂的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
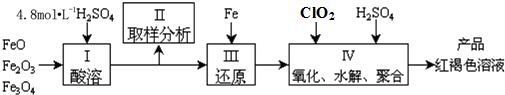
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com