甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等.工业上利用煤在高温下气化得到的水煤气合成甲醇、甲醚.请回答下列问题:

(1)写出煤的气化(生成水煤气)的主要化学反应方程式
.
(2)一定温度下,若反应CO(g)+H
2O(g)?CO
2(g)+H
2(g)在一密闭容器中进行,能判定该反应达平衡状态的是
(填序号).
A.容器中气体的密度不变 B.v(CO)
正=v(CO
2)
逆 C.混合气体中c(H
2)=c(H
2O) D.容器内的物质的量不变
(3)利用水煤气合成甲醚的三步反应为:
①2H
2(g)+CO(g)?CH
3OH(g)△H=-90.8kJ?mol
-1②2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)△H=-23.5kJ?mol
-1③CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H=-41.3kJ?mol
-1则由H
2和CO生成CH
3OCH
3和CO
2的热化学方程式为:
.
(4)CO和H
2可用于合成甲醇(CH
3OH),如图甲是CO在不同温度下的平衡转化率与压强的关系图,则温度t
1、t
2、t
3三者的高低关系是
,实际生产控制在t
1℃、1.3×10
4kPa左右,选择此压强的理由是
.
(5)某温度下.2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)的平衡常数为400,此温度下,在2L密闭容器中加入3.28mol CH
3OH,10分钟达平衡,则该时间内由甲醇生产甲醚的反应速率为v(CH
3OCH
3)=
.若此时再分别加入1mol CH
3OH 和2mol的H
2O(g),则此时”v
正
v
逆(填“>”“=”“<”).
(6)有研究者在催化剂、5.0MPa条件下,由CO和H
2直接制备甲醚,结果如图乙所示,CO的转化率随温度升高而降低的原因是
.




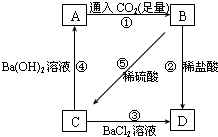 现有A、B、C、D四种溶液,在进行焰色反应时,火焰颜色都为黄色,它们之间转化关系如图所示.已知B为NaHCO3,请回答下列问题:
现有A、B、C、D四种溶液,在进行焰色反应时,火焰颜色都为黄色,它们之间转化关系如图所示.已知B为NaHCO3,请回答下列问题: