
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol?L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol?L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
| △c |
| △t |
| 消耗量 |
| 起始量 |
| [NO2]2 |
| [N2O4] |
| [NO2]2 |
| [N2O4] |
| 0.060mol/L |
| 60s |
| 0.122 |
| 0.04 |
| 1 |
| 0.36 |
| 0.5x |
| (0.080-x)2 |
| 1 |
| 0.36 |
| 0.020 |
| 0.080 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
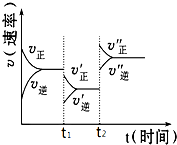 如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )
如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )| A、t1时,减小了A或B的物质的量的浓度 |
| B、t2时,升高了温度 |
| C、t2时,增大了压强 |
| D、t1时,加了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
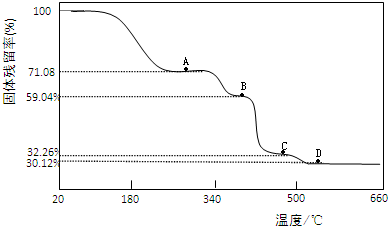
| 固体样品的剩余质量 |
| 固体样品的起始质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑥ | B、②③⑤ |
| C、①②③⑥ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
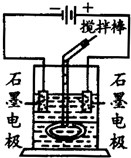
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强 |
| B、除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤后分液、干燥、蒸馏即可 |
| C、淀粉、蛋白质、油脂均是天然高分子化合物 |
| D、不慎将苯酚沾到皮肤上应立即用酒精清洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com