
 翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅.
翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅.分析 (1)非金属性越强,电负性越强,金属性越弱,电负性越强;
(2)铬24号元素,铬元素失去3个电子变成Cr3+,所以Cr3+核外有21个电子,根据构造原理写出其核外电子排布式;
(3)原子数相同,价电子数相同的分子为等电子体;根据草酸根离子中C原子的价层电子对数判断;单键中含有1个σ键,双键中含有一个σ键和一个π键;
(4)利用均摊法计算该物质的化学式,根据化合价的代数和为零计算.
解答 解:(1)非金属性越强,电负性越强,金属性越弱,电负性越强,非金属性:O>Si>Al>Na,则电负性:O>Si>Al>Na;
故答案为:O>Si>Al>Na;
(2)铬24号元素,铬元素失去3个电子变成Cr3+,所以Cr3+核外有21个电子,根据构造原理知,该离子核外电子排布式为:1s22s22p63s23p63d3,
故答案为:1s22s22p63s23p63d3;
(3)原子数相同,价电子数相同的分子为等电子体,则与H2O互为等电子体的一种分子是H2S;草酸根离子中每个C原子形成一个C=O、C-C、C-O,则C原子形成的σ键数目为3,即价层电子对数为3,所以为sp2杂化;H2C2O4分子含有2个O-H,2个C-O,2个C=O,1个C-C,则共含有7个σ键,所以1mol H2C2O4分子中含有的σ键的数目为 7NA;
故答案为:H2S;sp2;7NA;
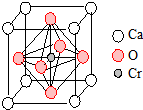
(4)晶胞中O原子数为$\frac{1}{2}$×6=3,Ca原子数为$\frac{1}{8}$×8=1,Cr原子数为1,则化学式为CaCrO3,当该晶体中部分Ca2+被相同数目的La3+替代时,部分铬由+4价转变为+3价,
化合物中La3+和Ca2+的物质的量之比为$\frac{x}{1-x}$(x<0.1),则晶胞中含有x个La3+和(1-x)个Ca2+,
设+3价Cr与+4价Cr的物质的量分别为m和n,
则m+n=1,
由化合价的代数和为零得:3x+2(1-x)+3m+4n=6,
解得:n=1-x,m=x,则三价铬与四价铬的物质的量之比为$\frac{x}{1-x}$,
故答案为:$\frac{x}{1-x}$.
点评 本题考查较为综合,题目难度较大,涉及电负性的判断、电子排布式、杂化类型的判断、σ键的数目的计算、晶胞的计算等,注意利用均摊法计算晶胞的构成,注意利用化合价代数和为零的原则计算.


科目:高中化学 来源: 题型:选择题
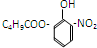 满足的有机物,下列描述中正确的是( )
满足的有机物,下列描述中正确的是( )| A. | 分子中有2种含氧官能团 | B. | 能发生取代、加成、消去、氧化反应 | ||
| C. | 1mol该有机物最多消耗3mol NaOH | D. | 苯环上的一溴代物最多有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳化钙(CaC2)的电子式:Ca2+[:C::C:]2- | |
| B. | ${\;}_{8}^{18}$O2-离子的结构示意图: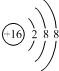 | |
| C. | 2-甲基-2-丙醇的结构简式: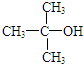 | |
| D. | Na2S水解的离子方程式:S2-+2H2O?2H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③④ | C. | ③④⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的Na2S溶液中,S2-的数目小于0.1 NA | |
| B. | 0.1 mol丙烷中含有的共价键数目为0.8 NA | |
| C. | 标准状况下,11.2 L甲醇中含有的分子数目为0.5 NA | |
| D. | 0.1 mol氧化钠和过氧化钠的混合物中含有的离子总数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

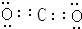 ,Z与氢元素形成的化合物溶于水后,溶液的pH>7(填“<”、“>”或“=”).
,Z与氢元素形成的化合物溶于水后,溶液的pH>7(填“<”、“>”或“=”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地球上CH4、CO2等气体含量上升容易导致温室效应加剧,进而引发灾难性气候 | |
| B. | 大量焚烧田间秸秆会产生雾霾,“雾”和“霾”为不同类别的分散系 | |
| C. | 太阳光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 | |
| D. | PbO2具有氧化性和导电性,可用作铅蓄电池正极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加水稀释,电离平衡正向移动,溶液中n(H+)减小 | |
| B. | 加热,电离平衡正向移动,溶液中c(CH3COO-)增大 | |
| C. | 通入少量HCl气体,电离平衡逆向移动,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,电离平衡逆向移动,溶液中c(H+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
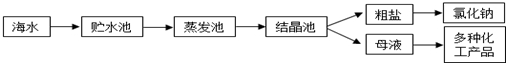
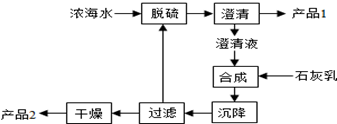
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com