
| A. | 当v(N2)=3v(H2)=2v(NH3)时,说明正逆反应速率相同 | |
| B. | 使用催化剂可以降低反应的活化能,有利于提高反应速率 | |
| C. | 因为反应的△H<0,所以其他条件一定时,降低温度反应速率增大 | |
| D. | 因为是气体分子数减少的反应,所以其他条件一定时,增大压强反应速率增大 |
分析 A、v(N2)=3v(H2)=2v(NH3)未指明正逆反应速率;
B、催化剂可以降低反应的活化能,有利于提高反应速率;
C、降低温度,反应速率减小,与反应为吸放热无关;
D、增大压强反应速率增大,与反应前后气体的物质的量变化无关;
解答 解:A、v(N2)=3v(H2)=2v(NH3)未指明正逆反应速率,不能说明达到平衡状态,所以不能说明正逆反应速率相同,故A错误;
B、催化剂可以降低反应的活化能,有利于提高反应速率,故B正确;
C、降低温度,反应速率减小,与反应为吸放热无关,故C错误;
D、增大压强反应速率增大,与反应前后气体的物质的量变化无关,所以没有因果关系,故D错误;
故选B.
点评 本题考查了化学平衡反应速率的影响因素分析判断,主要是温度、压强、催化剂对平衡的影响等,题目较简单.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:解答题

 ;写成B与足量NaHCO3溶液完全反应的化学方程式:
;写成B与足量NaHCO3溶液完全反应的化学方程式: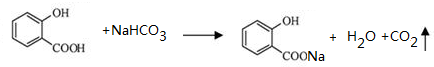 .
. .
. )是一种重要的有机合成中间体.根据图中提示的信息,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
)是一种重要的有机合成中间体.根据图中提示的信息,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X气体是F3O2,它具有还原性 | |
| B. | X气体是OF2,它具有氧化性 | |
| C. | 在F2与NaOH反应时,F2既是氧化剂又是还原剂 | |
| D. | 在反应中还有NaFO生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,将pH=11的氢氧化钠溶液稀释100倍后,溶液的pH=13 | |
| B. | pH=1的盐酸和醋酸溶液,分别加水稀释100倍后醋酸溶液pH更小 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,醋酸溶液消耗NaOH的物质的量更多 | |
| D. | pH=1的洁厕剂中c(H+)是pH=6的洗发液中c(H+)的105倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在容积为10L的容器中,850℃和t1℃(高于850℃)时分别发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0
在容积为10L的容器中,850℃和t1℃(高于850℃)时分别发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳、二氧化氮、一氧化氮都是大气污染物,在空气中都能稳定存在 | |
| B. | 高锰酸钾或重铬酸钾不能与草酸或铝粉存放在同一个药品柜里 | |
| C. | 二氧化硅、五氧化二磷都是酸性氧化物,都与水反应生成相应的含氧酸 | |
| D. | 氧化钠、氢氧化钠、都是含氧化合物,与水反应产物相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com