
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
(1)已知相关的化学键键能数据如下:
化学键 | H-H | C-O | | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=______kJ·mol-1(用数值表示),则△H3=______kJ·mol-1(用△H1和△H2表示)。
(2)向恒温、恒容密闭容器中充入一定量的CO(g)和H2(g)进行①反应,下列能说明反应达到平衡状态的是_____(填编号,下同)。
a.体系压强保持不变
b.v正(CO) = v逆(H2)
c.CO与CH3OH的物质的量之比保持不变
d.每消耗1molCO的同时生成1molCH3OH
e.混合气体的密度保持不变
(3)向同温、同体积的甲、乙、丙三个密闭容器中分别充入气体进行①反应。甲容器:2mol H2和1molCO;乙容器:1mol H2和0.5mol CO;丙容器:1mol CH3OH。恒温、恒容下反应达平衡时,下列关系正确的是________。
a.转化率:甲>乙 b.反应放出的热量数值Q:Q甲 = 2Q乙
c.CO的质量m:m甲= m丙> 2m乙 d.容器内压强P:P甲=P丙<2P乙
【答案】-99 △H2-△H1 ac ad
【解析】
(1)利用键能计算,△H1=反应物的总键能-生成物的总键能,反应②-反应①即得△H3。
(2)a.反应前后气体分子数不等,体系压强保持不变,则达平衡状态;
b.CO与H2的化学计量数不等,则v正(CO) = v逆(H2)不是平衡状态;
c.只要平衡移动,CO与CH3OH的物质的量之比发生改变,现比值保持不变,则达平衡状态;
d.不管反应是否达到平衡,每消耗1molCO的同时生成1molCH3OH,C不一定达平衡状态;
e.气体的质量不变、容器的体积不变,混合气体的密度始终不变,e不一定达平衡状态。
(3)a.甲的浓度为乙的二倍,则甲相当于乙加压,平衡正向移动,则转化率甲>乙,a正确;
b.甲中气体的物质的量是乙的二倍,且平衡正向移动,所以反应放出的热量数值Q甲 > 2Q乙 ,b错误;
c.甲与丙是等效平衡,CO的质量m甲= m丙;甲中气体的物质的量是乙的二倍,且平衡正向移动,则m甲<2m乙,c错误;
d.甲与丙是等效平衡,容器内压强P甲=P丙;乙相当于甲的体积减为原来的一半,则平衡正向移动,P甲<2P乙,d正确。
(1)利用键能进行计算,△H1=(1076+2×436-3×413-343-465)kJ/mol=-99kJ/mol;
反应②-反应①即得△H3=(△H2-△H1)kJ/mol。答案为:-99;△H2-△H1;
(2)a.反应前后气体分子数不等,体系压强保持不变,则达平衡状态;
b.CO与H2的化学计量数不等,则v正(CO) = v逆(H2)不是平衡状态;
c.只要平衡移动,CO与CH3OH的物质的量之比发生改变,现比值保持不变,则达平衡状态;
d.不管反应是否达到平衡,每消耗1molCO的同时生成1molCH3OH,C不一定达平衡状态;
e.气体的质量不变、容器的体积不变,混合气体的密度始终不变,e不一定达平衡状态。
故ac能说明反应达平衡状态。答案为:ac;
(3)a.甲的浓度为乙的二倍,甲相当于乙加压,平衡正向移动,则转化率甲>乙,a正确;
b.甲中气体的物质的量是乙的二倍,且平衡正向移动,所以反应放出的热量数值Q甲 > 2Q乙 ,b错误;
c.甲与丙是等效平衡,CO的质量m甲= m丙;甲中气体的物质的量是乙的二倍,且平衡正向移动,则m甲<2m乙,c错误;
d.甲与丙是等效平衡,容器内压强P:P甲=P丙;乙相当于甲的体积减为原来的一半,则平衡正向移动,P甲<2P乙,d正确。
故ad正确。答案为:ad。


科目:高中化学 来源: 题型:
【题目】氯原子对O3分解有催化作用:①O3+Cl===ClO+O2 ΔH1,②ClO+O===Cl+O2 ΔH2。大气臭氧层的分解反应是③O3+O===2O2 ΔH,该反应的能量变化示意图如图所示,下列叙述中,正确的是( )
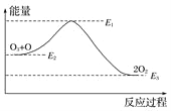
A.反应O3+O===2O2的ΔH=E1-E3B.反应O3+O===2O2的ΔH=E2-E3
C.O3+O===2O2是吸热反应D.ΔH=ΔH1+ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示甲、乙是电化学实验装置。
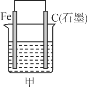
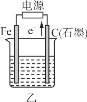
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为__________________________________。
②乙中总反应的离子方程式为____________________________________。
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为_________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为__________________________。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入________(填写物质的化学式)________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。
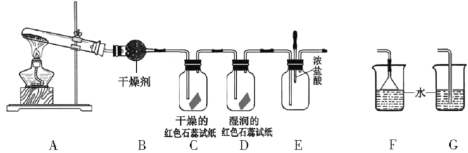
(实验探究)
(1) A中制备氨气的化学反应方程式_________
(2)A中的反应___________(填“是”或“不是”)氧化还原反应。
(3)A装置还可用于制取气体___________ (只填一种)
(4)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是_____ L
(5)实验室收集氨气的方法是___________
(6)检验氨气的方法是__________
(7)C、D装置中颜色会发生变化的是___________ (填“C”或“D”)
(8)当实验进行一段时间后,挤压E装置中的胶头滴管,滴人1-2滴浓盐酸,可观察到的现象是___________
(9)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是___________ (填“F”或“G”)。
(知识拓展)
(10)生石灰与水反应生成Ca(OH)2并放出热量化学方程式 [CaO+H2O==Ca(OH)2]。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列 ___________ 物质代替(填序号)。
A.碱石灰(NaOH与CaO的固体混合物) B.NaOH 固体
C.硫酸溶液 D.石灰石(含CaCO3)
(知识应用)
(11)2010年11月9日晚,我省宁德市一冷冻厂发生氨气泄漏事件,500多居民深夜大转移。假如你在现场,你会采用什么自救为法? ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
汽车彻底改变了我们生活,成为我们的不可或缺的交通工具之一。汽车尾气系统中的催化转化器,可有效降低尾气中的CO、NO和NO2等向大气的排放,在催化转化器的前半部发生的反应为2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
【1】上述催化器中发生的反应属于
A.复分解反应B.分解反应C.置换反应D.不属于四种基本反应
【2】关于反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)中,下列说法正确的是
2CO2(g)+N2(g)中,下列说法正确的是
A.CO作氧化剂B.CO发生氧化反应
C.NO被氧化D.NO作还原剂
【3】已知汽车尾气处理反应能量过程如下图,下列说法正确的是
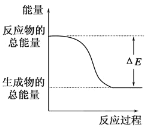
A.该反应为放热反应
B.该反应为吸热反应
C.形成N≡N化学键需要吸收热量
D.反应物的总能量小于生成物的总能量
【4】下列反应条件的改变对该反应速率的影响正确的是
A.升高温度能减慢反应速率
B.增大反应物浓度能减缓反应速率
C.达到平衡时,CO能100%转化为CO2
D.使用催化剂能加快该反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数,下列说法正确的是( )
A.标况下,11.2L甲醇中含有的电子数9NA
B.6.0g甲醛(HCHO)和醋酸的混合物中含有的原子总数为0.8NA
C.100mL0.1mol/L的KAl(SO4)2溶液中含有的阳离子总数小于0.02NA
D.分别由H2O2和KMnO4制备等量的氧气转移的电子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油酸甘油酯和硬脂酸甘油酯均是天然油脂的成分。 它们的结构简式如下图所示。

下列说法错误的是
A. 油酸的分子式为C18H34O2
B. 硬脂酸甘油酯的一氯代物共有54种
C. 天然油脂都能在NaOH溶液中发生取代反应
D. 将油酸甘油酯氢化为硬脂酸甘油酯可延长保存时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸来测定某![]() 溶液的浓度,甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
溶液的浓度,甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管未用标准盐酸润洗
B.开始时酸式滴定管尖嘴部分有气泡,滴定后气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛![]() 溶液的锥形瓶滴定前用
溶液的锥形瓶滴定前用![]() 溶液润洗2~3次
溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应过程中的先后顺序,下列评价正确的是
A.向浓度都为0.1mol/L的FeCl3和CuCl2加入铁粉,溶质CuCl2首先与铁粉反应
B.向过量的Ba(OH)2溶液中滴加少量的KAl(SO4)2溶液,开始没有白色沉淀生成
C.向浓度都为0.1mol/L 的Na2CO3和NaOH的混合溶液通入CO2气体,NaOH首先反应
D.向浓度为0.1mol/L的FeCl3溶液中,加入质量相同、颗粒大小相同的铁和铜,铜单质首先参加反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com