
| A. | CaCO3难溶于水,是弱电解质 | |
| B. | 进行中和滴定操作时眼睛应注视锥形瓶中溶液颜色的变化 | |
| C. | 用pH试纸测溶液的pH应预先润湿 | |
| D. | 蒸干FeCl3溶液可得到FeCl3固体 |
分析 A.电解质的强弱与溶解性无关;
B.根据锥形瓶中溶液颜色变化来判断滴定终点;
C.湿润pH试纸时,被测定的溶液的浓度减小;
D.加热溶液会促进盐的水解.
解答 解:A.电解质的强弱与溶解性无关,在溶液中完全电离的电解质为强电解质,CaCO3难溶于水,但是溶于水的部分能够完全电离是强电解质,故A错误;
B.根据锥形瓶中溶液颜色变化来判断滴定终点,所以进行中和滴定操作时眼睛应注视锥形瓶中溶液颜色的变化,故B正确;
C.湿润pH试纸时,被测定的溶液的浓度减小,测定的pH会产生误差,所以测定pH时,pH试纸不能湿润,故C错误;
D.加热溶液会促进盐的水解,蒸干FeCl3溶液最终可得到Fe(OH)3固体,故D错误.
故选B.
点评 本题考查了强弱电解质的判断、中和滴定原理、PH试纸的使用、盐的水解原理等,题目难度不大,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性强弱:c>b | |
| B. | 元素a和其他3种元素均能形成共价化合物 | |
| C. | 元素d和其他3种元素均能形成离子化合物 | |
| D. | 元素a、b、c各自最高和最低化合价的代数和分别为0、4、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
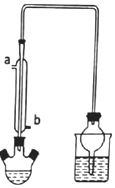 溴乙烷是一种重要的有机化工原料,沸点为38.4℃.实验室可用溴化钠、浓硫酸和乙醉反应制备溴乙烷,实验装置如图(加热和夹持等装置略).
溴乙烷是一种重要的有机化工原料,沸点为38.4℃.实验室可用溴化钠、浓硫酸和乙醉反应制备溴乙烷,实验装置如图(加热和夹持等装置略).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、H+、SO42-、HCO3- | B. | Na+、K+、Cl-、SO42- | ||
| C. | Cu2+、K+、OH-、NO3- | D. | Ag+、K+、NO3-、Cl-? |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 现有下列几种有机物:
现有下列几种有机物: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| B. | 常温下,浓度均为0.1mol/L①醋酸、②盐酸、③醋酸钠溶液,水电离程度的顺序为③>①>② | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 物质的浓度相同的①氯化铵溶液、②硫酸钠溶液、③碳酸氢钠溶液,pH的顺序为:③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 除去Fe(OH)3胶体中的FeCl3 | 过滤 | 分散质粒子的大小不同 |
| B | 除去Na2CO3中的NaHCO3 | 加热 | 稳定性不同 |
| C | 分离KNO3和NaCl | 重结晶 | KNO3的溶解度大于NaCl |
| D | 分离食用油和汽油 | 分液 | 食用油和汽油的密度不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
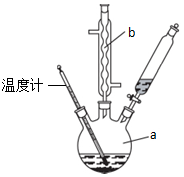 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,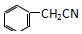 +2H2O+H2SO4$\stackrel{100-130℃}{→}$+NH4HSO4
+2H2O+H2SO4$\stackrel{100-130℃}{→}$+NH4HSO4 ,混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应.
,混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com