
| 元素编号 | a | b | c | d | e | f | g |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -2 | +3 | +1 | +1 |
| A. | 氢化物稳定性的强弱:b>d | |
| B. | 金属性的强弱:f<g | |
| C. | 元素e的氧化物只能与酸反应 | |
| D. | 最高价氧化物对应的水化物的碱性:e<g |
分析 a、f、g的最高正价为+1,为第ⅠA族元素,原子半径a<f<g,故a为H元素、f为Li元素、g为Na元素.b、d的最低负极为-2价,处于第ⅥA族,b的原子半径较小,故b为O元素,d为S元素.c、e的最高正价为+3,处于第ⅢA族,c的原子半径较小,故c为B元素、e为Al元素,据此解答.
解答 解:分析表中数据得:a为H元素,f为Na元素,g为K元素,b为O元素,d为S元素,c为B元素,e为Al元素.
A、非金属性:b>d,所以氢化物稳定性的强弱:b>d,故A正确;
B、同主族从上往下金属性增加,所以金属性的强弱:f<g,故B正确;
C、元素e为Al元素,氧化铝既可以与酸反应也可以与碱反应,故C错误;
D、金属性越强最高价氧化物对应水化物的碱性越强,所以最高价氧化物对应的水化物的碱性e<g,故D正确;
故选C.
点评 本题考查结构性质位置关系应用,难度中等,根据化合价与原子半径推断元素是解题关键,注意元素周期律的理解掌握.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
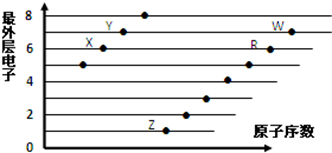
| A. | X和R在同一周期 | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的酸性:X>Y | |
| D. | X、Z形成的化合物中阴阳离子个数比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是吸热反应都需要加热 | |
| B. | 物质的化学变化都伴随着能量变化 | |
| C. | 表示中和热的热化学方程式:NaOH+HCl═NaCl+H2O△H=-57.3 kJ•mol-1 | |
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,前者的反应热比后者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R为ⅤA族元素 | |
| B. | R的氢化物的水溶液属于强酸 | |
| C. | 氧化剂与还原剂的物质的量之比为5:1 | |
| D. | R2在常温常压下一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | J | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com