
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:

(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率;②________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42—,该反应的离子方程式为________________________________________________________________________。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入稀盐酸、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应的化学方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62—
Sn2++4Cl-+2HgCl2=SnCl62—+Hg2Cl2↓
6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量________(填“偏高”、“偏低”或“不变”,下同);
②若不加HgCl2,则测定的Fe3+量________。
(4)①可选用________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是________________________________________________________________________(用离子方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀硝酸、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。
请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:________________________________________________________;
b.沉淀:__________________________________________________________;
c.分离,洗涤;
d.烘干,研磨。
(1)抑制Fe3+的水解 (2)14Fe3++FeS2+8H2O=15Fe2++2SO42—+16H+ (3)①偏低 ②偏高
(4)①KSCN(或OH) 4Fe2++O2+4H+=4Fe3++2H2O ②a.向溶液中加入过量的酸性高锰酸钾溶液,搅拌 b.滴加NaOH溶液,调节溶液pH为3.2~3.8
【解析】 (1)Fe3+的水解方程式为Fe3++3H2O??Fe(OH)3+3H+,酸过量,抑制Fe3+的水解。(2)根据题给信息,写出反应物和生成物,因为在酸性环境下反应,则介质为H2O和H+,根据电子得失守恒和离子所带电荷守恒可以写出离子方程式。(3)①SnCl2不足,Fe3+没有完全反应,生成的Fe2+偏少,则消耗的K2Cr2O7标准溶液体积偏小,则测定的Fe3+量偏低;②若不加HgCl2,过量的Sn2+也能够被K2Cr2O7氧化,则消耗的K2Cr2O7标准溶液体积偏高,则测定的Fe3+量偏高。(4)①Fe3+与KSCN的络合反应或者Fe3+与OH的显色反应均可以用于鉴别。产生Fe3+的原因是Fe2+被空气中的氧气氧化。②“过滤”后的溶液中有Fe2+、Al3+、Mg2+以及少量Fe3+,首先将Fe2+完全氧化为Fe3+,然后控制pH,只使Fe(OH)3沉淀,从表格数据可以分析,控制pH为3.2~3.8。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第5讲化学反应与能量练习卷(解析版) 题型:填空题
(1)①根据下列图示,写出反应的热化学方程式___________________________。

②根据如图所示情况,判断下列说法中正确的是________。

A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应热值小于41 kJ·mol-1
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是________________________________________。
(3)如图是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为_________________________________。

a、b两条曲线产生区别的原因很可能是_________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第2讲化学常用计量练习卷(解析版) 题型:选择题
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )。
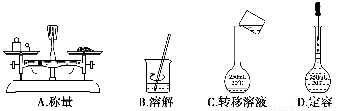
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第15讲实验化学练习卷(解析版) 题型:实验题
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO4—+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________(填仪器名称)。
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
A.稀硫酸 B.浓硝酸 C.稀硝酸 D.稀盐酸
(3)某同学设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)。

方案二 重量法 操作流程如下:

(4)步骤②中除用H2O2外还可以使用的物质是__________________________。
(5)步骤②是否可以省略________,理由是________________________________
_______________________________________。
(6)步骤④中一系列操作依次是:过滤、洗涤、________、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量________g(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第14讲物质结构与性质练习卷(解析版) 题型:填空题
Ⅰ.下列化合物中,含有非极性共价键的离子化合物是( )。
A.CaC2 B.N2H4 C.Na2S2 D.NH4NO3
Ⅱ.图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。

回答下列问题:
(1)图B对应的物质名称是________,其晶胞中的原子数为________,晶体类型为________。
(2)d中元素的原子核外电子排布式为________。
(3)图A中由二种元素组成的物质中,沸点最高的是________,原因是________________________________________________________________________,该物质的分子构型为________,中心原子的杂化轨道类型为________。
(4)图A中的双原子分子中,极性最大的分子是________。
(5)k的分子式为________,中心原子的杂化轨道类型为________,属于________分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第12讲化学实验基础练习卷(解析版) 题型:实验题
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:

(1)SO2气体还原Fe3+的产物是________(填离子符号),参加反应的SO2和Fe3+的物质的量之比是________。
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是____________________________________。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿 B.石棉网
C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是__________________________
______________________________________________。
(6)能表明I-还原性弱于SO2的现象是_____________________________
___________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第12讲化学实验基础练习卷(解析版) 题型:选择题
下列实验设计能完成或实验结论合理的是( )。
A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾?淀粉试纸检验,观察试纸颜色的变化
B.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,该铝热剂不含氧化铁
C.测氯水的pH可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
D.用新制氢氧化铜悬浊液可以鉴别甲酸、甲酸甲酯、乙酸、乙酸乙酯四种物质
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第10讲金属元素及其化合物练习卷(解析版) 题型:填空题
Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。

钴的有关性质如下:Co(OH)2具有两性。钴的主要物理、化学参数与铁、镍接近,属铁族元素。
结合以上信息试回答下列问题:
(1)Co(OH)2的制备是在CoCl2溶液中加稍过量的氨水,不用NaOH溶液的原因是________________________________(用化学方程式表示)。制得的Co(OH)2不宜在空气中长期放置,会被空气中的O2氧化,化学方程式为_____________________________________________________。
(2)如图,已知钴的氢氧化物加热至290 ℃时已完全脱水,则1000 ℃时,剩余固体的成分为________________________(填化学式);在290~500 ℃范围内,发生的反应的化学方程式为__________________________________________。
(3)已知常温下,在0.10 mol·L-1 CoCl2溶液中加入氨水充分搅拌,有Co(OH)2沉淀生成,当溶液的pH=8时,c(Co2+)=________mol·L-1(Ksp[Co(OH)2]=1.6×10-15)。常温下反应Co2++2H2O??Co(OH)2+2H+的平衡常数为
_______________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题8电化学基础练习卷(解析版) 题型:选择题
下图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑,下列说法错误的是( )。

A.a、b可能是同种材料的电极
B.该装置可能是原电池,电解质溶液为稀硝酸
C.该装置可能是电解池,电解质溶液为稀盐酸
D.该装置可看作是铜锌原电池,电解质溶液是稀硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com