
化学实验中有时需要将某些溶液或试剂进行酸化,下列酸化方法正确的是
A.检验C2H5Cl中的氯元素:先将C2H5Cl与NaOH溶液混合后加热,再加盐酸酸化
B.提高KMnO4溶液的氧化能力:用盐酸将KMnO4溶液酸化
C.鉴定溶液中是否有Fe2+:先将溶液用硝酸酸化,再加入KSCN溶液
D.检验溶液中是否有SO42-:先将溶液用足量的盐酸酸化,再加入BaCl2溶液
科目:高中化学 来源: 题型:
环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下表是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂)。
| 结构 简式 |
|
|
|
| 键线 式 |
(环己烷) |
(环丁烷) |
|
①△+H2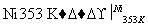
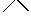
②□+H2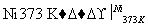
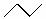
③+H2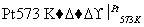
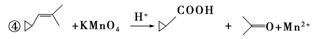
回答下列问题:
(1)环烷烃与________是同分异构体。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是________(填名称),判断依据为________________________。
(3)环烷烃还可与卤素单质、卤化氢发生类似的开环加成反应,如环丁烷与HBr在一定条件下反应,其化学方程式为________________________(不需注明反应条件)。
(4)写出鉴别环丙烷与丙烯的一种方法,试剂_______;现象与结论_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作。回答下列问题:
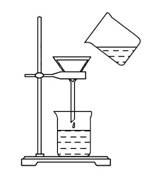
(1)将样品置于烧杯中,加入适量的水溶解,同时用玻璃棒搅拌,搅拌的作用是
______________。
(2)向溶液中加入适量的________溶液,使氯化钾转化为沉淀。
(3)将混合液进行过滤,过滤装置和操作如图,指出图
中的两处错误:
①______________________________________________________________;
②______________________________________________________________。
(4)为了从滤液中得到硝酸钾晶体,可选用的两种结晶方法是:
①______________________________________________________________;
②______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应的实质就是旧键的断裂和新键的形成。欲探讨发生化学反应时分子中化学键在何处断裂的问题,近代科技常用同位素示踪原子法。如有下列反应:
可以推知,物质 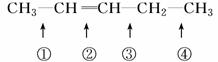 发生此反应时断裂的化学键应是
发生此反应时断裂的化学键应是
A.①③ B.①④ C.② D.②③
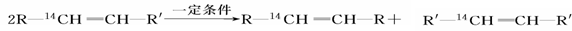
查看答案和解析>>
科目:高中化学 来源: 题型:
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H = -566.0 kJ/mol
H2O(g)=H2O(1) ∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池正极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
研究钠及其化合物有重要意义。
(1)NaOH是实验室中最常用的试剂之一。实验室进行某实验需要0.5 mol·L-1的氢氧化钠溶液约480 mL,根据溶液配制的过程,回答下列问题:
①实验除了需要托盘天平(带砝码)、药匙、烧杯和玻璃棒外,还需要的其他玻璃仪器
是 。
②根据计算得知,需用托盘天平(带砝码)准确称量NaOH固体 g。
⑵Na2O2可作为呼吸面具和潜水艇里氧气的来源。Na2O2作为供氧剂时可能发生的反应
有 、 。
⑶NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。
已知NaNO2能发生如下反应: 2NaNO2+4HI===2NO↑+I2+2NaI+2H2O
①上述反应中,氧化剂是________。每生成标准状况下的NO气体2.24L,反应中被氧化的HI 的物质的量是 mol。
②某厂废切削液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________。
A.NaCl B.NH4Cl C.HNO3 D.浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
|
| i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色;iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是 ________________________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是__________________________。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成。进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a的目的是______________________________________________________。
②由实验a、b不能判断白雾中含有HCl,理由是________________________________。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是_____________________。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是________。
②用离子方程式解释现象iii中黄绿色褪去的原因:______________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com