
【题目】下图是制备氯气并进行一系列相关实验的装置(有些夹持设备已略)。

(1)写出A装置生成氯气的化学反应方程式____________________________。
(2)装置B除及吸收HCl外还有两个作用, 请写出: _________________,________________。
(3)装置C的实验目的是验证氯气是否具有漂白性, 为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是________(填编号)。
编号 | 1 | 2 | 3 | 4 |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 硅胶 | 浓硫酸 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是_______________________该现象_______(填“能”或“不能”)说明溴的非金属性强于碘,原因是____________________。
(5)有人提出,装置F中可改用足量的Na2S2O3溶液吸收余氯,试写出相应的离子方程式:__________________________________。
【答案】Ca(ClO)2+4HCl![]() CaCl2+Cl2↑+2H2O 观察后面管道是否堵塞 作储气瓶 2 E中溶液分为两层,上层(苯层)为紫红色 不能 过量的Cl2也可将I-氧化为I2 S2O3 2- + 4Cl2 + 5H2O = 2SO4 2- + 8Cl- + 10H+
CaCl2+Cl2↑+2H2O 观察后面管道是否堵塞 作储气瓶 2 E中溶液分为两层,上层(苯层)为紫红色 不能 过量的Cl2也可将I-氧化为I2 S2O3 2- + 4Cl2 + 5H2O = 2SO4 2- + 8Cl- + 10H+
【解析】
装置A的作用是漂粉精中的次氯酸钙与浓盐酸反应制备氯气;装置B的作用是除去氯气中混有的氯化氢气体,同时还可以利用长颈漏斗中液面的观察是否堵塞,关闭止水夹,还可以起到储存氯气的作用;装置C的作用是利用有色布条是否褪色验证氯气是否具有漂白性;装置D的作用是通过观察溴化钠和碘化钾是否反应比较氯、溴、碘的非金属性;装置F的作用是吸收过量氯气,防止污染环境。
(1)漂粉精的有效成分Ca(ClO)2具有强氧化性,Ca(ClO)2与浓盐酸反应生成Cl2,反应的化学方程式为Ca(ClO)2+ 4HCl(浓)= CaCl2+2Cl2↑+ 2H2O,故答案为:Ca(ClO)2+ 4HCl(浓)= CaCl2+2Cl2↑+ 2H2O;
(2)装置B中饱和食盐水可以除去氯气中混有的氯化氢气体;打开止水夹,如果C中发生堵塞,B中压强增大,则B中长颈漏斗中液面上升,形成水柱,可以观察是否堵塞;关闭止水夹,可以通过长颈漏斗中液面的变化,储存少量的氯气,起到储气瓶的作用,故答案为:观察后面管道是否堵塞;作储气瓶;
(3)为了验证氯气是否具有漂白性,I中加入湿润的有色布条,II为U型管,可加入固体干燥剂,得到干燥的Cl2,III中加入干燥的有色布条,即可证明Cl2是否具有漂白性,故d项正确,故答案为:d;
(4)装置D中试剂为溴水,加入到E中,Br2与I反应生成I2,所以实验现象为:E中溶液分为两层,上层(苯层)为紫红色;Cl2通入D与NaBr反应生成Br2,可能会有Cl2剩余,所以把D中溶液加入到E中,也有可能是Cl2将I氧化为I2,因此不能说明溴单质的氧化性强于碘,故答案为:E中溶液分为两层,上层(苯层)为紫红色;不能;过量的Cl2也可将I-氧化为I2;
(5)Cl2具有较强氧化性,能与Na2S2O3溶液发生氧化还原反应反应生成硫酸钠、氯化氢和水,反应的离子方程式为:S2O3 2- + 4Cl2 + 5H2O = 2SO4 2- + 8Cl- + 10H+,故答案为:S2O3 2- + 4Cl2 + 5H2O = 2SO4 2- + 8Cl- + 10H+。


科目:高中化学 来源: 题型:
【题目】某烃的含氧衍生物可以作为无铅汽油的抗爆震剂,它的相对分子质量不超过100,含C的质量分数为68.2%,含H的质量分数为13.6%,其余为氧。请计算回答:
(1)该化合物的相对分子质量是____________________。
(2)写出该化合物的分子式___________________________。
(3)若该化合物不能与钠反应产生氢气,红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式。_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯内盛有浓 HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb 都有剩余.下列说法正确的是( )
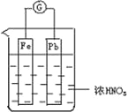
A. Fe比Pb活泼,始终作负极
B. Fe在浓硝酸中钝化,始终不会溶解
C. 电池停止工作时,烧杯中生成了硝酸铁
D. 利用浓硝酸做电解质溶液不符合“绿色化学”思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学中,最理想的“原子经济”是原子利用率为100%。下列反应类型最能体现“原子经济性”原则的是
①取代反应 ②加成反应 ③酯化反应 ④水解反应 ⑤加聚反应
A.①②B.③④C.②⑤D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以氧化铝为原料可制得一些物质。
(1)碳热还原法可合成氮化铝(AlN)
已知:2Al2O3(s)==4Al(g)+3O2(g) △H1=+3351KJmol﹣1
2C(s)+O2(g)==2CO(g) △H2=-221KJmol﹣1
2Al(g)+N2(g)==2AlN(s) △H3=-318KJmol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是________________________________________________,
(2)电解法可制取铝。以石墨作电极电解熔融 Al2O3(加入Na3AlF6为助熔剂)
①电解时铝在_____________产生(填阴极或阳极)
②电解过程中作阳极的石墨易消耗,原因是________________________。
(3)二氧化碳甲烷化再利用
①已知反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)写出该反应的平衡常数表达式________________________
CH4(g)+2H2O(g)写出该反应的平衡常数表达式________________________
②据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. H2的摩尔质量是2g B. 1mol OH-的质量是17g
C. 摩尔是物质的质量单位 D. 1mol气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com