
(10分)下图是元素周期表的框架图(未标出元素周期表的边界),请根据下面提问回答表中指定元素的相关问题:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
① |
② |
|
③ |
|
|
|
④ |
|
|
|
|
|
|
|
|
|
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
|
⑨ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑩ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该两性氢氧化物与⑦的氢化物的水溶液反应的离子方程式 。
(3)电子式表示④与⑦形成化合物的过程 。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是
(填酸的化学式)。
(5)⑥、⑦、⑨电子数相等的简单离子的半径由大到小依次为 (用元素符号表示)。
(6)④⑤两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 (填编号)。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
c.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(10分) (1) 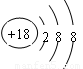 (2) Al , Al(OH)3
+ OH- = AlO2- +2H2O
(2) Al , Al(OH)3
+ OH- = AlO2- +2H2O
(3)
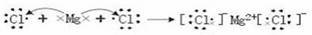
(4) HClO4 (5) S2- >Cl->K+ (6) 镁, bc
【解析】考查元素周期表都结构及元素周期律的应用。根据元素在周期表中的位置可知,①~⑩分别是C、N、F、Mg、Al、S、Cl、Ar、K、Br。
(1)中化学性质最不活泼的元素是稀有气体Ar,其原子结构示意图为 。
。
(2)表中能形成两性氢氧化物的元素是Al,氢氧化铝能溶于盐酸中,方程式为Al(OH)3 + OH- = AlO2- +2H2O。
(3)镁和氯气形成的是离子键,其形成过程为
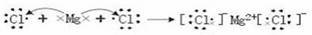 。
。
(4)非金属性越强,最高价氧化物的水化物中酸性。由于F没有含氧酸,所以应是高氯酸。
(5)核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以顺序是S2- >Cl->K+。
(6)镁的金属性强于铝的。比较元素金属性强弱的依据
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属。但是ⅠA族和ⅡA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后强碱再可能与盐发生复分解反应。
5.依据金属活动性顺序表(极少数例外)。
6.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,金属性逐渐减弱;同主族中,由上而下,随着核电荷数的增加,金属性逐渐增强。
7.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。
所以答案选bc。


科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2012年天津市十二所重点学校联考高考化学模拟试卷(一)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com