
| 固体成分 | 气体成分 | |
| A | Na2CO3 | CO2、H2O、O2 |
| B | Na2CO3 | H2O、O2 |
| C | Na2CO3、Na2O2 | O2 |
| D | Na2CO3、Na2O2、NaOH | O2 |
| A. | A | B. | B | C. | C | D. | D |
分析 Na2O2与NaHCO3混合后,在密闭容器中充分加热,可能发生的反应有:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O ①,2Na2O2+2CO2=2Na2CO3+O2 ②,2Na2O2+2H2O=4NaOH+O2↑ ③,由于二氧化碳与氢氧化钠反应生成水,可以认为CO2先与Na2O2反应,然后水再与Na2O2发生反应,
若剩余固体只有一种,则只能为Na2CO3,即①×2+②得到4NaHCO3+2Na2O2=4Na2CO3+O2↑+2H2O,实际NaHCO3可以过量,再发生分解反应生成二氧化碳、水蒸气;
根据的分析可以知道,$\frac{n(Na2O2)}{n(NaHCO3)}$=0.5,即水蒸气与O2的物质的量之比为2:1;
若剩余气体只有一种,只能为O2,即CO2和H2O全部反应掉,所以①×2+②+③即可得到4NaHCO3+4Na2O2=4Na2CO3+4NaOH+2O2↑,过氧化钠过量就不会有CO2以及H2O剩余,据此判断.
解答 解:发生反应有:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O ①
2Na2O2+2CO2=2Na2CO3+O2 ②
2Na2O2+2H2O=4NaOH+O2↑③
A.剩余固体只有一种,则只能为Na2CO3,即①×2+②得到4NaHCO3+2Na2O2=4Na2CO3+O2↑+2H2O,实际NaHCO3可以过量,再发生分解反应生成二氧化碳气体,所以气体可以为:CO2、H2O、O2,故A正确;
B.根据A的分析可以知道,剩余固体只有一种,则只能为Na2CO3,$\frac{n(Na2O2)}{n(NaHCO3)}$=0.5,即水蒸气与O2的物质的量之比为2:1,剩余为H2O、O2,故B正确;
C.剩余气体只有一种,即为O2,即CO2和H2O全部反应掉,所以①×2+②+③即可得到4NaHCO3+4Na2O2=4Na2CO3+4NaOH+2O2↑,过氧化钠过量就不会有CO2以及H2O剩余,故C错误;
D.剩余气体只有一种,即为O2,即CO2和H2O全部反应掉,所以①×2+②+③即可得到4NaHCO3+4Na2O2=4Na2CO3+4NaOH+2O2↑,过氧化钠过量就不会有CO2以及H2O剩余,故D正确;
故选:C.
点评 本题考查了有关混合物反应的计算,题目难度较大,解题根据是根据题中信息判断反应产物的组成,注意质量守恒在化学计算中的应用,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 阴离子的半径:X>Y>Z | B. | 单质的氧化性:X>Y>Z | ||
| C. | 元素的非金属性:X>Y>Z | D. | 气态氢化物的稳定性:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇汽油是一种纯净物 | |
| B. | 乙醇汽油作燃料不会产生碳氧化物等有害气体,其优点是可以减少对环境的污染 | |
| C. | 乙醇和汽油都可作溶剂,也可相互溶解 | |
| D. | 乙醇和乙二醇互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
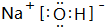 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
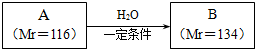
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4三溶液中,c(NH4+)大小顺序为:①>②>③ | |
| B. | Na2CO3溶液中,2c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol/L | |
| D. | 10 mL pH=12NaOH溶液中加入pH=2的HA溶液至pH刚好等于7,则溶液体积V(总)=20 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1g | B. | 0.2g | C. | 0.3g | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com