
| △c |
| △t |
| n |
| V |
| △c |
| △t |
| ||
| 2 |
| 5 |
| 6 |
| 5 |
| 6 |
| 4-1 |
| 2 |
| 总质量 |
| 体积 |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| A、Na与水反应比与C2H5OH反应强烈 |
| B、丙酮(CH3COCH3)分子中的氢原子比乙烷分子中的氢原子更易被卤素原子取代 |
| C、甲酸的酸性比乙酸强 |
| D、相等质量的甲醇和乙醇分别与足量金属钠反应,甲醇产生的H2更多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg片做负极,电极反应:Mg→Mg2++2e- |
| B、Al片做负极电极反应:Al+4OH-→[Al(OH)4]-+3e- |
| C、电子从Mg电极沿导线流向Al电极 |
| D、Al片上有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
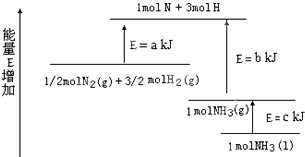
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
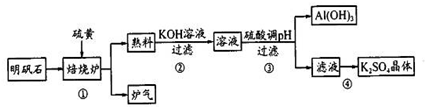
查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com