
【题目】用NA表示阿伏加德罗常数,下列说法正确的是
A. 1 mol OH-中含有9NA个电子
B. 1 L 1 mol/L的AlCl3溶液中含有NA个Al3+
C. 28 gCO气体中含有NA个氧原子
D. 常温常压下11.2 L甲烷气体含有的分子数为0.5NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关乙烯的说法,其中错误的是( )
A.乙烯分子的双键中有一键较易断裂
B.烯分子里所有原子都在同一个平面上,且碳氢键之间的键角约为120°
C.乙烯的化学性质比乙烷活泼
D.乙烯和环丙烷  的分子组成符合通式CnH2n , 因此它们属于同系物
的分子组成符合通式CnH2n , 因此它们属于同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3: 物质结构与性质]
A、B、C、D为元素周期表中前四周期的四种元素,且原子序数依次增大,C、D同周期,且A、B、C均不在同一周期,其中A与D同主族,且该主族中有三种非金属元素,B为非金属元素且原子最外层有3对成对电子,C元素位于元素周期表第10列。请回答下列问题:
(1)C元素的原子序数为________,基态D原子的简化电子排布式为________。
(2)与A同一周期的所有主族元素中第一电离能小于A的元素共有_______种。
(3) D元素可形成DX3的卤化物,性质和结构与AX3类似(X表示卤素元素),在水溶液中强烈水解,请写出DCl3与水反应的化学方程式:____________。
(4) 如图为D2B3的分子结构图,B杂化方式为____________。

(5) 试比较A、B形成的简单氢化物的熔沸点的高低并解释:________ (简单氢化物用分子式表示)。
(6) 研究晶体结构的最常用方法是________;如图为一种含C和D两种元索的品体的晶胞图,呈六方结构,晶胞参数为底面边长为anm、高为bmm。
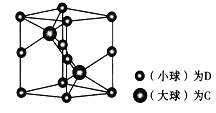
①该晶胞组成物质的化学式为__________。
②已知D和C的相对原子质量分别为M1和M2,若晶体密度为ρg/cm3,NA表示阿伏加德罗常数,用合理表达式表示该晶体的密度为________g/cm3 (列出计算式即可,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内含量虽然很少,但在维持正常生命活动中是不可缺少的。可通过哪一实例得到证明
A. 缺镁时叶片变黄 B. 油菜缺硼时只开花不结果
C. 动物血液中钙盐含量太低会抽搐 D. 缺磷时会影响ATP的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() (立方烷)的分子式均为C8H8,下列说法正确的是
(立方烷)的分子式均为C8H8,下列说法正确的是
A. Z的二氯代物有四种
B. X的同分异构体只有Y和Z
C. X、Y、Z中只有X 的所有原子可能处于同一平面
D. X、Y、 Z均可使溴的四氯化碳溶液因发生加成反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )
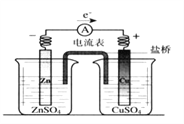
A. 铜片上有气泡逸出
B. 取出盐桥后,电流计依然发生偏转
C. 反应中,盐桥中的K+会移向CuSO4溶液
D. 反应前后铜片质量不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ/mol
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
(1)甲醇蒸气完全燃烧的热化学反应方程式为______________。
(2)反应②中的能量变化如图所示,则ΔH2=________ kJ/mol(用E1、E2表示)。

(3)H2(g)的燃烧热为________。
(4)目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.已知常温常压下:
①CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H1=﹣354.8kJmol﹣1
②2CO(g)+O2(g)═2CO2(g)△H2=﹣566kJmol﹣1
则反应2CO2(g)+4H2O(g)═2CH3OH(l)+3O2(g)△H=________.
(5)氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均为2H2+O2===2H2O。酸式电池中的电解质是酸,其负极反应可表示为2H2-4e-===4H+,则其正极反应可表示为_____________
(6)根据下式所表示的氧化还原反应设计一个原电池:2Fe3++Cu=2Fe2++Cu2+ .装置采用烧杯和盐桥,请画出原电池的装置图(标出电极材料和电解质溶液)______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是______________
(2)C、B可按原子个数比1:1形成离子化合物乙的电子式___________
(3)C、D、E三种元素的离子半径由小到大的顺序是____________(用元素符号填写)。
(4)E单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是:____________________
(5)简述比较D与E金属性强弱的实验方法:_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
A.NaOH(s)
B.CH3COONa(s)
C.NH4Cl(s)
D.Na2CO3(s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com