
| A. | C0(NH2)2 | B. | NH4NO3 | C. | NH4HCO3 | D. | (NH4)2SO4 |
分析 氮肥中的含氮量=$\frac{所有N原子的相对原子质量}{物质的相对分子质量}$×100%,据此计算含氮肥料中的含氮量.
解答 解:A、C0(NH2)2的含氮量=$\frac{28}{60}$×100%=46.7%;
B、NH4NO3的含氮量=$\frac{28}{80}$×100%=35%;
C、NH4HCO3的含氮量=$\frac{14}{79}$×100%=17.7%;
D、(NH4)2SO4的含氮量=$\frac{28}{128}$×100%=21.9%.
含氮量最高的是C0(NH2)2.
故选A.
点评 本题考查学生元素质量分数的计算,注意氮肥中的含氮量=$\frac{所有N原子的相对原子质量}{物质的相对分子质量}$×100%计算公式的应用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液:S2-、NO3-、Cl-、Na+ | |
| C. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| D. | 由水电离出来的c(H+)=10-10mol•L-1的溶液:Na+、SO42-、S2-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
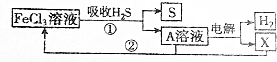
| A. | A溶液中溶质的成分为FeCl2 | B. | X为Cl2并且在阴极上生成的 | ||
| C. | 废气中的H2S最终转化为S和H2 | D. | 只有流程①为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸的物质的量浓度是0.5mol•L-1 | B. | 氢氧化钠溶液的体积是250mL | ||
| C. | 铁和硅的物质的量之比为2:1 | D. | 铁和硅的质量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,不可制得Fe(OH)3胶体 | |
| B. | 胶体与其他分散系的本质区别是胶体能发生丁达尔效应 | |
| C. | 用半透膜分离淀粉和食盐的混合液 | |
| D. | Fe(OH)3胶体逐渐加入稀硫酸,会产生沉淀而后溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com