
于密闭容器中进行如下反应:H2(g)+I2(g)  2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右下图所示。则符合图示的正确判断是
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右下图所示。则符合图示的正确判断是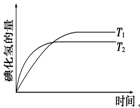
| A.T1>T2,ΔH>0 | B.T1>T2,ΔH<0 | C.T1<T2,ΔH>0 | D.T1<T2,ΔH<0 |
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
| a |
| 200b |
| a |
| 200b |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 553~573K |
| 1373K |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 3 |
| O | - 3 |
n(S
|
91:9 | 1:1 | 9:91 | ||||
| pH | 8.2 | 7.2 | 6.2 |
| O | 2- 3 |
| O | - 3 |
| O | - 3 |
| O | 2- 3 |
| O | 2- 3 |
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省高三第四次检测化学试卷(解析版) 题型:选择题
于密闭容器中进行如下反应:H2(g)+I2(g)  2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右下图所示。则符合图示的正确判断是
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右下图所示。则符合图示的正确判断是

A.T1>T2,ΔH>0 B.T1>T2,ΔH<0 C.T1<T2,ΔH>0 D.T1<T2,ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com