
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一试管中加入2mL5%H2O2和1mLH2O,向另一试管中加入2mL 10%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
分析 A.AlCl3溶液中加过量的6mol•L-1NaOH溶液,反应生成偏铝酸钠;
B.乙酸与碳酸钠反应后,与乙酸乙酯分层;
C.检验Fe3+时滴加KSCN溶液;
D.溶液的总体积不同,混合后浓度不同.
解答 解:A.AlCl3溶液中加过量的6mol•L-1NaOH溶液,反应生成偏铝酸钠,不能制备Al(OH)3悬浊液,故A错误;
B.乙酸与碳酸钠反应后,与乙酸乙酯分层,则振荡后静置分液,并除去有机相的水,故B正确;
C.检验Fe3+时直接滴加KSCN溶液,观察是否出现血红色,故C错误;
D.溶液的总体积不同,混合后浓度不同,则不能探究催化剂对H2O2分解速率的影响,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、离子检验、影响反应速率的因素、混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Cl-、NO3- | B. | Ca2+、Cl-、CO32- | C. | K+、H+、HCO3- | D. | Cu2+、H+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +30.0kJ?mol-1 | B. | -80.5kJ?mol-1 | C. | -30.0kJ?mol-1 | D. | +80.5kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
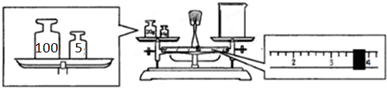
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
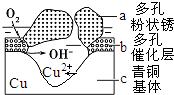 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义.
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
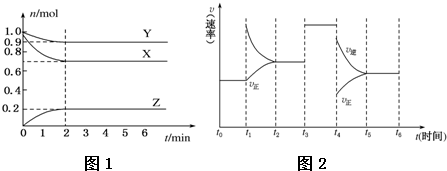
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
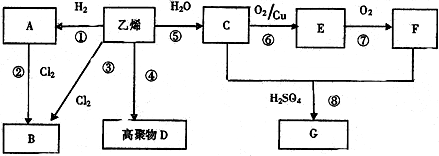
 ,F中所含官能团的名称是羧基;A的二溴代物的结构有2种.
,F中所含官能团的名称是羧基;A的二溴代物的结构有2种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Fe3+完全水解,生成氢氧化铁胶体的数目为NA | |
| B. | 22.4 LCl2 分别与足量的Cu、Fe完全反应转移电子数分别为2 NA、3NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5 NA | |
| D. | 1 mol/L Mg(NO3)2溶液中含有NO3-的数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com