
| A. | Al3+有较强的吸附性 | |
| B. | Al3+与悬浮物生成沉淀 | |
| C. | Al3+与水反应生成的氢氧化铝胶体,具有吸附性 | |
| D. | 明矾难溶于水 |
科目:高中化学 来源: 题型:选择题
| A. | 将二氧化碳通过过氧化钠使其增重ag 反应中转移电子数为 $\frac{a{N}_{A}}{14}$ | |
| B. | 1mol Cl2 通入水中,则n(HClO)+n(Cl-)+n(ClO-)=2NA | |
| C. | 常温常压下,3克含甲醛的冰醋酸中含有的原子总数为0.4NA | |
| D. | 2.24升的甲烷中含有的C-H键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(1{0}^{-8}+1{0}^{-10})}{2}$mol/L | B. | (10-8+10-10)mol/L | ||
| C. | (10-14-5×10-5)mol/L | D. | 2×10-10 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | OH-的物质的量 | ||
| C. | c(H+)×c(OH-) | D. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$、 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
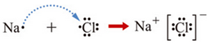
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②③ | C. | ②③⑤ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的物质的量浓度为2mol/L | |
| B. | CaCl2的物质的量为1mol | |
| C. | 取出50 mL后,剩余溶液中CaCl2的物质的量浓度为0.5mol/L | |
| D. | 该溶液中水的体积为100 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com