
下列图示与对应的叙述相符的是
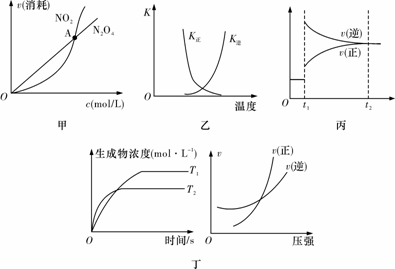
A.图甲表示在恒容密闭容器中,恒温条件下发生的可逆反应2NO2(g)N2O4(g),各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
B.图乙曲线表示反应2A(g)+B(g)2C(g) ΔH>0,正、逆反应的平衡常数K随温度的变化
C.图丙表示对反应2X(g)+Y(g)Z(s)+3W(g) ΔH<0在t1时刻增大压强
D.图丁表示反应aA(g)+bB(g)cC(g)+dD(g):a+b>c+d;T1<T2;ΔH<0
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
下列实验现象与对应结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 常温下将Cu片放入浓H2SO4中 | 生成刺激性气味气体 | Cu与浓H2SO4反应生成SO2 |
| B | Al2(SO4)3溶液中滴加过量氨水 | 生成白色胶状物质 | Al(OH)3不溶于氨水 |
| C | 向某溶液中加入KSCN溶液,再向溶液中加入新制氯水 | 溶液先不显红色,加入氯水后变红色 | 该溶液中含有Fe2+ |
| D | 向某溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 该溶液中存在I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
氢溴酸、硫酸钡是用途广泛的工业产品。实验室利用SO2、Br2模拟工业上精制氢溴酸同时得副产品硫酸钡,有关流程如下:

(1)实验室制Br2的反应原理为2NaBr+3H2SO4(浓)+MnO2 2NaHSO4+MnSO4+ Br2↑+2H2O 则下列装置中,可用来制取Br2的是 (填字母,下同),可用来吸收SO2尾气的是 。
2NaHSO4+MnSO4+ Br2↑+2H2O 则下列装置中,可用来制取Br2的是 (填字母,下同),可用来吸收SO2尾气的是 。

(2)试剂a为 ,使用冰水的目的是 。
(3)加入Na2SO3的目的是除去 ,所加Na2SO3的量的多少是否会影响氢溴酸的产量? (填“影响”或“不影响”)。
(4)为得到纯净的BaSO4晶体,洗涤沉淀的具体操作为:
。
(5)工业上氢溴酸常显淡黄色,可能的原因是:①含有杂质Fe3+②含有杂质Br2③含有杂质Fe3+、Br2,只用下列一种试剂就能分析产生淡黄色的原因,该试剂是 (填字母)。 a.KMnO4 b.CCl4 c.NaOH d.KSCN
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)常温下,0.1 mol/L的盐酸的pH= ;
(2)常温下,某醋酸溶液的pH=1,其浓度 0.1 mol/L(填“>”、“<”或“=”);
(3)用标准盐酸来滴定待测氢氧化钠溶液,选用 (填“甲基橙”或“石蕊”)作指示剂,若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果(氢氧化钠的浓度) (填“偏高”、“偏低”或“无影响”);
(4)向饱和的AgCl溶液中加入NaBr(aq),有淡黄色沉淀生成,说明Ksp(AgCl) Ksp(AgBr)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生反应NO2+SO2SO3+NO,平衡时NO2与SO2体积比为1∶6,则平衡常数K= ;多余的NO与空气(设空气中氧气和氮气体积比为1∶4)按一定比例通入水中即可完全吸收,VNO∶V空气= 。NO可以与活性炭发生如下反应C(s)+2NO(g)N2(g)+CO2(g),若温度恒定,提供足量的活性炭,增大NO的浓度,NO的转化

率 (选填“增大”、“减小”、“不变”或“无法确定”)。
(2)CO可以组成燃料电池,用以提供电能,根据右图所示写出正极反应式:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是某校实验小组设计的一套原电池装置,下列有关描述不正确的是

A.此装置能将化学能转变为电能
B.石墨电极的反应式:O2+2H2O+4e—=4OH—
C.电子由Cu电极经导线流向石墨电极
D.电池总的反应是:2Cu+O2+4HCl=2CuCl2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为( )
A.3:1 B.2:1 C.1:1 D.1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
若在加入铝粉能放出H 的溶液中,下列各组离子一定不能大量共存的是( )
的溶液中,下列各组离子一定不能大量共存的是( )
A. Na 、Fe
、Fe 、SO
、SO 、Cl
、Cl B. Ba
B. Ba 、Mg
、Mg 、HCO
、HCO 、NO
、NO
C. Na 、K
、K 、NO
、NO 、CO
、CO D. K
D. K 、NO
、NO 、AlO
、AlO 、OH
、OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com