
【题目】在①二氧化碳②二氧化硫③氟氯烃中,造成酸雨的主要因素是______含量的增加;全球气候变暖是由于______含量的急剧增加;造成臭氧空洞的主要物质是______(以上均要求填序号)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )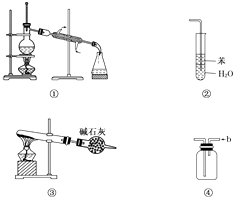
A.装置①常用于分离互不相溶的液体混合物
B.装置②可用于吸收氨气,能够防止倒吸
C.以NH4HCO3为原料,装置③可用于制备少量CO2
D.装置④a口进气可收集Cl2、NO2等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,某溶液中由水电离产生的c(H+)=10﹣12 , 则下列各组离子在该溶液中一定可以大量共存的是( )
A.K+、Na+、AlO2﹣、Cl﹣
B.Na+、Cl﹣、SO42﹣、HCO3﹣
C.NH4+、Na+、NO3﹣、SO42﹣
D.Ba2+、Na+、Cl﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )
A.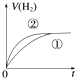
B.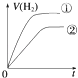
C.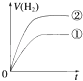
D.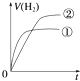
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备硅单质时,主要化学反应如下:
⑴SiO2+2C ![]() Si(粗硅)+2CO
Si(粗硅)+2CO
⑵Si(粗)+2Cl2 ![]() SiCl4
SiCl4
⑶SiCl4+2H2 ![]() Si (纯)+4HCl
Si (纯)+4HCl
对上述三个反应叙述中,不正确的是( )
A.(1)(3)为置换反应
B.(1)(2)(3)均为氧化还原反应
C.(2)为化合反应
D.反应物中硅元素均被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( ) 
A.氯化钠固体不导电,所以氯化钠是非电解质
B.向纯水中加入碳酸钠能使水的电离平衡正向移动,水的离子积增大
C.如右图研究的是铁的吸氧腐蚀,实验中红色首先在食盐水滴的中心出现
D.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 的△H<0△S<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行实验,有关现象和解释均正确的是( )
选项 | 足量 | 甲中试剂 | 乙中试剂 | 现象 | 解释 |
A | CO2 | Na2SiO3 | BaCl2 | 甲浑浊、乙澄清 | 酸性:HCl>H2CO3>H2SiO3 |
B | Cl2 | 紫色石蕊 | Fe(SCN)2 | 开始均变红 | Cl2溶于水显酸性 |
C | SO2 | 品红溶液 | KMnO4 | 均褪色 | SO2具有漂白性 |
D | NH3 | AgNO3 | AlCl3 | 现象相同 | NH3H2O电离出OH﹣ |
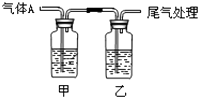
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相关物质的溶度积常数见下表(25℃):
物质 | Mg(OH)2 | CH3COOAg | AgCl | Ag2CrO4 |
Ksp(单位略) | 1.1×10﹣11 | 2.3×10﹣3 | 1.8×10﹣10 | 1.9×10﹣12 |
下列有关说法中不正确的是( )
A.浓度均为0.2 molL﹣1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B.将0.001 molL﹣1的AgN03溶液滴入0.001 molL﹣1的KCl和0.001 molL﹣1 的K2CrO4混合溶液中.先产生Ag2CrO4沉淀
C.0.11 molL﹣1的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9
D.在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、O、Na、Mg、S、Br是常见的六种元素.
(1)Br位于元素周期表第周期第族;Na和O形成1:1的化合物的电子式: . 该物质含有的化学键为: .
(2)用“>”或“<”填空:
稳定性 | 粒子半径 | 熔点 | 键的极性 |
NH3H2O | O2﹣Mg2+ | SO3 | H﹣O |
(3)已知多硫化钠一溴储能电池是一种二次电池,结构如图.电池总反应为:2Na2S3+2NaBr ![]() 3Na2S2+Br2①放电时Na+向极迁移(填“a或b,”).
3Na2S2+Br2①放电时Na+向极迁移(填“a或b,”).
②放电时负极的电极反应式为:
(4)已知N4为正四面体结构,N﹣N键能为167kJmol﹣1 , N≡N键能为942kJmol﹣1 . 写出N4(g)转化为N2(g)的热化学方程式 . 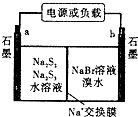
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com