
硫元素有多种化合价,可形成多种化合物.
(1)常温下用1mol•L﹣1200mLNaOH溶液恰好完全吸收0.1molSO2气体,此反应的离子方程式为 ,请用离子方程式表示该溶液PH>7的原因 H ,该溶液放置于空气中一段时间后,溶液的PH (填“增大”“减小”或“不变”)
(2)SO2能使酸性高锰酸钾溶液褪色,该反应的离子方程式为 ,实验室通常选择 (选填“稀盐酸”、“稀硫酸”)对高锰酸钾溶液进行酸化.
(3)课本中选用Na2S2O3与稀硫酸的反应来研究物质的温度对化学反应速率的影响.选用Na2S2O3来比较化学反应速率快慢的原因是 .
考点: 含硫物质的性质及综合应用.
分析: (1)依据反应定量关系分析判断,若n(SO2):n(NaOH)=1:2反应生成亚硫酸钠;亚硫酸钠水解显碱性;亚硫酸钠溶液在空气中能被氧气氧化;
(2)在酸性条件下,SO2与高锰酸钾反应生成硫酸钾、硫酸锰和水;
(3)Na2S2O3与稀硫酸的反应生成硫沉淀.
解答: 解:(1)常温下用1mol•L﹣1200mLNaOH溶液恰好完全吸收0.1molSO2气体,n(SO2):n(NaOH)=1:2反应生成亚硫酸钠,SO2+2OH﹣=H2O+SO32﹣,亚硫酸钠水解显碱性,其水解的离子方程式为:H2O+SO32﹣⇌HSO3﹣+OH﹣;亚硫酸钠具有较强的还原性,亚硫酸钠溶液放置于空气中一段时间后,会被空气中的氧气氧化为硫酸钠,硫酸钠在溶液中不水解,显中性,所以溶液的pH减小;
故答案为:SO2+2OH﹣=H2O+SO32﹣;H2O+SO32﹣⇌HSO3﹣+OH﹣;减小;
(2)在酸性条件下,SO2与高锰酸钾反应生成硫酸钾、硫酸锰和水,其反应的离子方程式为:5SO2+2MnO4﹣+2H2O=2Mn2++5SO42﹣+4H+;由于高锰酸钾具有强氧化性能氧化盐酸,所以不能用盐酸酸化而用硫酸酸化高锰酸钾;
故答案为:5SO2+2MnO4﹣+2H2O=2Mn2++5SO42﹣+4H+;稀硫酸;
(3)Na2S2O3与稀硫酸的反应生成硫沉淀,可以通过溶液中黄色浑浊出现的快慢来比较反应的快慢,所以能用Na2S2O3与稀硫酸的反应来研究物质的温度对化学反应速率的影响;
故答案为:Na2S2O3与稀硫酸反应可产生黄色的S沉淀,所以可通过溶液中产生黄色浑浊出现的快慢来比较反应的快慢.
点评: 本题考查了硫元素及其化合物的性质、反应产物定量分析判断、盐类水解应用、氧化还原反应、离子反应等,题目涉及的问题较多,侧重于考查学生对基础知识的应用能力,掌握基础是关键,题目难度中等.


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
已知反应3Cu+8HNO3(稀)═Cu(NO3)2+2NO↑+4H2O.当生成2molNO时,下列说法正确的是( )
|
| A. | 有2molHNO3被还原 | B. | 转移的电子数目为6mol |
|
| C. | 有8molHNO3参加反应 | D. | HNO3只作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应X+Y═M+N为放热反应,对该反应的说法正确是( )
A. X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因为该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在溶液中一定能大量共存的是( )
A. PH=2的溶液:K+、Na+、CH3COO﹣、CO32﹣
B. 与铝反应产生大量氢气的溶液:Mg2+、K+、HCO3﹣、NO3﹣
C. 使酚酞呈红色的溶液中:Na+、K+、SiO32﹣、AlO2﹣
D. FeBr2溶液中滴加KI淀粉溶液变为蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应X(g)+Y(g)⇌R(g)+Q(g)的平衡常数与温度的关系如表.830℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内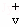 (X)=0.005mol/(L•s).下列说法正确的是( )
(X)=0.005mol/(L•s).下列说法正确的是( )
温度/℃ 700 800 830 1000 1200
平衡常数 1.7 1.1 1.0 0.6 0.4
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1200℃时反应R(g)+Q(g)⇌X(g)+Y(g)的平衡常数K=0.4
查看答案和解析>>
科目:高中化学 来源: 题型:
化学就是在原子、分子水平上研究物质的( )
①组成 ②结构 ③性质 ④变化 ⑤制备 ⑥应用.
A.①②③④ B.①③⑤ C.②④⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应的离子方程式正确的是( )
A.氢氧化钡溶液与稀硫酸的反应:OH﹣+H+=H2O
B.澄清的石灰水与稀醋酸反应:Ca(OH)2+2H+=Ca2++2H2O
C.在Ca(HCO3)2溶液中加入过量氢氧化钠溶液:Ca2++HCO3﹣+OH﹣=CaCO3↓+H2O
D.往澄清石灰水通入过量二氧化碳气体:CO2+OH﹣=HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度和压强下,30L某种气态纯净物中含有6.02×1023个分子,这些分子由1.204×1024个原子组成,下列有关说法中不正确的是( )
|
| A. | 标准状况下该纯净物若为气态,其体积约是22.4 L |
|
| B. | 该气体中每个分子含有2个原子 |
|
| C. | 若O2在该条件下为气态,则1 mol O2在该条件下的体积也为30 L |
|
| D. | 该温度和压强可能是标准状况 |
查看答案和解析>>
科目:高中化学 来源: 题型:
二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等.它的结构如图所示,下列说法正确的是( )

|
| A. | 二茂铁中Fe2+与环戊二烯离子(C5H5﹣)之间为离子键 |
|
| B. | 1mol环戊二烯中含有σ键的数目为5NA |
|
| C. | 分子中存在π键 |
|
| D. | Fe2+的电子排布式为1s22s22p63s23p63d44s2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com