

| A. | ①⑤ | B. | ②⑥ | C. | ①④ | D. | ①④⑥ |
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
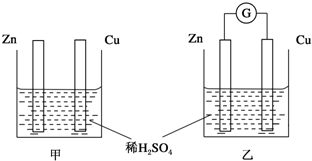
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都伴随着能量的变化 | |
| B. | H2O(气)-→H2O(液)该过程放出大量的热,所以该过程是化学变化 | |
| C. | 化学反应中能量的变化都表现为热量的变化 | |
| D. | 所有的物质一定存在化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
| 实验序号 | 金属质量/g | 金属状态 | C(H2SO4)/mol.-L | V(H2SO4)/mL | 溶液温度 | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.1 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.1 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.1 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.1 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.1 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.1 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.1 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使病毒的蛋白质发生变性 | |
| C. | 醋酸和硬脂酸互为同系物,C2H6和C9H20也一定互为同系物 | |
| D. | 丙氨酸和苯丙氨酸脱水缩合,最多可生成4种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 41 | B. | 42 | C. | 44 | D. | 46 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| B. | 取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 用渗析法除去淀粉中混有的NaCl | |
| D. | 已知${I}_{3}^{-}$?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com