
·ÖĪö £Ø1£©øł¾Żn=$\frac{m}{M}$¼ĘĖćČżÕßĪļÖŹµÄĮæÖ®±Č£¬·Ö×ÓŹżÄæÖ®±ČµČÓŚĪļÖŹµÄĮæÖ®±Č£¬½įŗĻĆæøö·Ö×ÓÖŠŗ¬ÓŠOŌ×ÓŹżÄæ¼ĘĖćø÷ĪļÖŹŗ¬ÓŠŃõŌ×ÓŹżÄæÖ®±Č£»
£Ø2£©øł¾Żn=$\frac{m}{M}$¼ĘĖć°±ĘųĪļÖŹµÄĮ棬ŌŁøł¾ŻV=nVm¼ĘĖć°±ĘųĢå»ż£¬½įŗĻHŌ×ÓŹżÄæĻąµČ¼ĘĖćĮņ»ÆĒāĪļÖŹµÄĮ棬ŌŁøł¾ŻV=nVm¼ĘĖćĮņ»ÆĒāµÄĢå»ż£»
£Ø3£©±źæöĻĀ6.72LSO2µÄĪļÖŹµÄĮæĪŖ$\frac{6.72L}{22.4L/mol}$=0.3mol£¬1L0.6mol•L-1NaOHČÜŅŗÖŠNaOHĪŖ1L”Į0.6mol/L=0.6mol£¬¶žÕßĪļÖŹµÄĮæÖ®±ČĪŖ0.3mol£ŗ0.6mol=1£ŗ2£¬Ōņ·¢Éś·“Ó¦£ŗSO2+2NaOH=Na2SO3+H2O£¬æÉÖŖn£ØNa2SO3£©=n£ØSO2£©£¬ŌŁøł¾Żc=$\frac{n}{V}$¼ĘĖćc£ØNa2SO3£©£®
½ā“š ½ā£ŗ£Ø1£©ÖŹĮæÖ®±ČĪŖ32£ŗ7£ŗ30µÄČżÖÖĘųĢåS02”¢CO”¢NOµÄĪļÖŹµÄĮæÖ®±ČĪŖ$\frac{32}{64}$£ŗ$\frac{7}{28}$£ŗ$\frac{30}{30}$=2£ŗ1£ŗ4£¬ŌņČżÕß·Ö×ÓŹżÖ®±ČĪŖ2£ŗ1£ŗ4£¬ŗ¬ÓŠŃõŌ×ÓŹżÖ®±ČĪŖ2”Į2£ŗ1”Į1£ŗ4”Į1=4£ŗ1£ŗ4£¬
¹Ź“š°øĪŖ£ŗ2£ŗ1£ŗ4£»4£ŗ1£ŗ4£»
£Ø2£©±ź×¼×“æöĻĀ£¬4.25g NH3µÄĪļÖŹµÄĮæĪŖ$\frac{4.25g}{17g/mol}$=0.25mol£¬ĘäĢå»żĪŖ0.25mol”Į22.4L/mol=5.6L£¬ÓėÖ®ŗ¬ÓŠĻąĶ¬ŹżÄæµÄĒāŌ×ÓµÄĮņ»ÆĒāĪŖ$\frac{0.25mol”Į3}{2}$=0.375mol£¬Ōņ±źæöĻĀĮņ»ÆĒāµÄĢå»żĪŖ0.25mol”Į22.4L/mol=8.4L£¬4.25g NH3ÖŠµŖŌ×ÓµÄĪļÖŹµÄĮæĪŖ£ŗ0.25mol£¬ĖłŅŌÓė0.25mol”Į30g/mol=7.5g£¬
¹Ź“š°øĪŖ£ŗ5.6£»8.4£»7.5£»
£Ø3£©±źæöĻĀ6.72LSO2µÄĪļÖŹµÄĮæĪŖ$\frac{6.72L}{22.4L/mol}$=0.3mol£¬1L0.6mol•L-1NaOHČÜŅŗÖŠNaOHĪŖ1L”Į0.6mol/L=0.6mol£¬¶žÕßĪļÖŹµÄĮæÖ®±ČĪŖ0.3mol£ŗ0.6mol=1£ŗ2£¬Ōņ·¢Éś·“Ó¦£ŗSO2+2NaOH=Na2SO3+H2O£¬×īŗóµĆµ½µÄČÜÖŹŹĒNa2SO3£¬æÉÖŖn£ØNa2SO3£©=n£ØSO2£©=0.3mol£¬Ōņc£ØNa2SO3£©=$\frac{0.3mol}{1L}$=0.3mol/L£¬
¹Ź“š°øĪŖ£ŗ0.3£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹµÄĮæÓŠ¹Ų¼ĘĖć”¢»Æѧ·½³ĢŹ½¼ĘĖćµČ£¬±Č½Ļ»ł“”£¬Ö¼ŌŚæ¼²éѧɜ¶Ō»ł“”ÖŖŹ¶µÄĄķ½āÕĘĪÕ£®


 ø÷µŲĘŚÄ©ø“Ļ°ĢŲѵ¾ķĻµĮŠ“š°ø
ø÷µŲĘŚÄ©ø“Ļ°ĢŲѵ¾ķĻµĮŠ“š°ø Š”²©ŹæĘŚÄ©“³¹Ų100·ÖĻµĮŠ“š°ø
Š”²©ŹæĘŚÄ©“³¹Ų100·ÖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Cl2O | B£® | H2SO4 | C£® | C2H5OH | D£® | KNO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ¼×“¼ĘūÓĶŹĒŅ»ÖÖŠĀÄÜŌ“Ēå½ąČ¼ĮĻ£¬æÉŅŌ×÷ĪŖĘūÓĶµÄĢę“śĪļ£®ÓŠ¹Ų·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ČēĻĀ£ŗ
¼×“¼ĘūÓĶŹĒŅ»ÖÖŠĀÄÜŌ“Ēå½ąČ¼ĮĻ£¬æÉŅŌ×÷ĪŖĘūÓĶµÄĢę“śĪļ£®ÓŠ¹Ų·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ČēĻĀ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
| ŹµŃéŠņŗÅ | 0.1mol/L NaClOČÜŅŗ/mL | 0.1mol/L NaClČÜŅŗ/mL | 0.2mol/L NaOHČÜŅŗ/mL | H2O/mL | Ę·ŗģČÜŅŗ | ĻÖĻó |
| ¢Ł | 4.0 | 0 | 0 | 4.0 | 3µĪ | ½ĻæģĶŹÉ« |
| ¢Ś | 0 | 4.0 | 4.0 | 0 | 3µĪ | ²»ĶŹÉ« |
| ¢Ū | 4.0 | 0 | 4.0 | 0 | 3µĪ | »ŗĀżĶŹÉ« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
| ŅŅĶ¬Ń§ÕżČ· | Ń”ÓĆŹŌ¼Į | ŹµŃéĻÖĻó |
| µŚŅ»ÖÖ·½·Ø | ||
| µŚ¶žÖÖ·½·Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 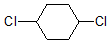 2ÖÖ | B£® | 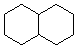 2ÖÖ | C£® | 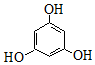 3 ÖÖ | D£® |  2ÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
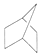 C£®CH2=CH-CH=CH2 D£®HOOCCH2CH2CH2Cl
C£®CH2=CH-CH=CH2 D£®HOOCCH2CH2CH2Cl
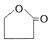 ŌņEµÄ½į¹¹¼ņŹ½NaOOCCH2CH2CH2OH£¬FÉś³ÉĪåŌŖ»·õ„µÄ»Æѧ·½³ĢŹ½HOOCCH2CH2CH2OH$”ś_{”÷}^{ÅØĮņĖį}$
ŌņEµÄ½į¹¹¼ņŹ½NaOOCCH2CH2CH2OH£¬FÉś³ÉĪåŌŖ»·õ„µÄ»Æѧ·½³ĢŹ½HOOCCH2CH2CH2OH$”ś_{”÷}^{ÅØĮņĖį}$ +H2O£®
+H2O£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ė®µÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ18g/mol | |
| B£® | Ņ»øöĖ®·Ö×ÓµÄÖŹĮæĪŖ18g | |
| C£® | 1molĖ®µÄÖŹĮæŹĒ18g | |
| D£® | 1molĖ®ÖŠŗ¬ÓŠ2øöĒāŌ×ÓŗĶ1øöŃõŌ×Ó |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com