
分析 (1)根据n=$\frac{\frac{m}{M}}{V}$计算出所得溶液的物质的量浓度;
(2)溶液具有均一性,取出溶液的浓度不变,根据m=cVM计算出需要氢氧化钠的质量;
(3)稀释过程中氢氧化钠的物质的量不变,根据c=$\frac{n}{V}$计算出稀释后氢氧化钠的浓度,稀释过程中氢氧化钠的质量不变.
解答 解:(1)实验室用20gNaOH配制成500mL溶液,所得溶液的浓度为:$\frac{\frac{20g}{40g/mol}}{0.5L}$=1 mol?L-1,
故答案为:1 mol?L-1;
(2)从中取出1mL,其物质的量浓度不变,仍然为1mol/L,取出溶液中含有氢氧化钠的质量为:40g/mol×1mol/L×0.001L=0.04g,
故答案为:1 mol?L-1;0.04 g;
(3)若将这1mL溶液用水稀释到100mL,稀释过程中溶质的物质的量不变,所得溶液中溶质的物质的量浓度是:$\frac{1mol/L×0.001L}{0.1L}$=0.01 mol?L-1;稀释过程中氢氧化钠的质量不变,含NaOH的质量仍然为0.04g,
故答案为:0.01 mol?L-1;0.04 g.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意掌握物质的量与摩尔质量、物质的量浓度之间的关系,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 436 kJ | B. | 557 kJ | C. | 920 kJ | D. | 618 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 没有明显变化 |
| ② | B+D | 有无色、无味气体生成 |
| ③ | B+C | 有白色沉淀生成 |
| ④ | A+D | 有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,平衡向右移动 | B. | 加入催化剂,Z的产率增大 | ||
| C. | 增大c(X),X的转化率增大 | D. | 降低温度,Y的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
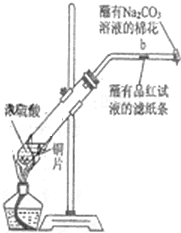 如图所示,将6.4g铜与12mL18mol•L-1浓硫酸在试管a中共热.据此回答:
如图所示,将6.4g铜与12mL18mol•L-1浓硫酸在试管a中共热.据此回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com