
| A、在容器中,任意时刻vA=vB=vC | ||
B、若A、B、C都是气体,
| ||
| C、当vA=vB=v′A=v′B时,表示反应已达到平衡状态 | ||
D、当v′A=
|
| [C]3 |
| [A]?[B]2 |
| [C]3 |
| [A]?[B]2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、食用植物油均可水解生成氨基酸 |
| B、铺路用的沥青主要含有C、H、O等元素 |
| C、做衣服的棉、麻的主要成分是纤维素 |
| D、煤经过汽化、液化等物理变化可转化为清洁用品 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | Na2S2O3溶液的体积和物质的量浓度 | H2SO4的体积和物质的量浓度 | |
| A | 20℃ | 15mL 0.1mol?L-1 | 15mL 0.1mol?L-1 |
| B | 20℃ | 10mL 0.2mol?L-1 | 10mL 0.2mol?L-1 |
| C | 50℃ | 50mL 0.1mol?L-1 | 50mL 0.1mol?L-1 |
| D | 50℃ | 5mL 0.5mol?L-1 | 5mL 0.5mol?L-1 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(H2) |
| n(CO) |
| n(H2) |
| n(CO) |
| n(Mn) |
| n(Cu) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②④ | C、③④ | D、只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、通H2的一极是正极,通O2的一极是负极 |
| B、通O2的一极是正极,通H2的一极是负极 |
| C、工作一段时间后电解质溶液pH增大 |
| D、此电池能发出淡蓝色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氯离子的结构示意图: | ||
B、作为相对原子质量测定标准的碳核素:
| ||
C、氯化镁的电子式: | ||
D、用电子式表示氯化氢分子的形成过程: + + → →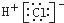 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com