
A.5.6 g
B.11.2 g?
C.33.6 g
D.10.6 g
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:阅读理解
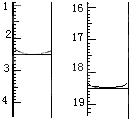
实验数据 实验序号 |
FeSO4溶液体积读数/mL | |
| 滴定前 | 滴定后 | |
| 第一次 | 0.10 | 16.20 |
| 第二次 | 0.30 | 15.31 |
| 第三次 | 0.20 | 15.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 名称 | 乙二酸 | 乙二酸晶体 |
| 分子式 | H2C2O4 | H2C2O4?2H2O |
| 颜色状态 | 无色固体 | 无色晶体 |
| 溶解度(g) | 8.6(20℃) | - |
| 熔点(℃) | 189.5 | 101.5 |
| 密度(g?cm-3) | 1.900 | 1.650 |
查看答案和解析>>
科目:高中化学 来源:2014届辽宁省丹东市高二上学期期末考试化学试卷(解析版) 题型:实验题
(11分)氧化还原滴定法是科研和生产中测定溶液中物质浓度的常用方法。
⑴莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银滴定待测液,进而测定溶液中Cl-的浓度 [Ksp(AgCl) =1.56×10-10,Ksp(Ag2CrO4)=1.10×10-12,Ag2CrO4为砖红色]
①滴定终点的现象是_________________;
②硝酸银标准液应装在 式滴定管中滴定。
③已知该滴定适宜的酸度范围是pH 6.5~10.5,但当溶液中有铵盐存在,c(NH4+)<0.05mol/L时,应将溶液的pH控制在6.5~7.2。下列有关说法你认为合理的有__________。
a.若溶液pH<6.5,则Cr2O72—+H2O 2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
b.若溶液中有铵盐存在时,当pH>7.2,则有可能因为生成[Ag(NH3)2]+,影响实验结果
c.滴定时应剧烈摇动,以使被AgCl沉淀吸附的Cl- 及时释放出来,防止滴定终点提前
⑵氧化还原滴定是水环境监测常用的方法,可用于测定废水中的化学耗氧量(单位:mg/L——每升水样中还原性物质被氧化需O2的质量)。某废水样100.00mL,用硫酸酸化后,加入0.01667mol/L的K2Cr2O7溶液25.00mL,使水样中的还原性物质在一定条件下完全被氧化。然后用0.1000mol/L的FeSO4标准溶液滴定剩余的Cr2O72-,实验数据记录如下:
|
实验序号 |
FeSO4溶液体积读数/mL |
|
|
滴定前 |
滴定后 |
|
|
第一次 |
0.10 |
16.20 |
|
第二次 |
0.30 |
15.31 |
|
第三次 |
0.20 |
15.19 |
①完成离子方程式的配平:
___Cr2O72-+___Fe2++____
_______ ____Cr3++____Fe3++____H2O
②计算废水样的化学耗氧量。 (写出计算过程,结果精确到小数点后一位。)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省高三12月月考(理综)化学部分 题型:实验题
已知乙二酸(HOOC―COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。某校研究性学习小组为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为_________________________________________。
(2)向盛有少量乙二酸饱和溶液的试管中滴入用硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_________________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ = _____ Mn2+ + _____ CO2↑ + _____ H2O
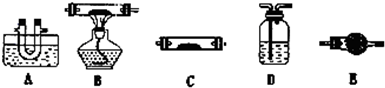
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
实验发现,装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红,
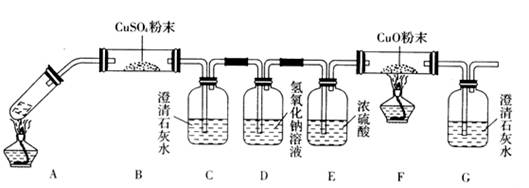
据此,乙二酸分解的产物为___________________________。上述装置中,D的作用是_____
__________________________________________。装置F中发生反应的化学方程式为:
___________________________________________________________。
(4)该小组同学将2.52 g草酸晶体(H2C2O4•2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是______________________
________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com