
����Ŀ����ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ:CO��g��+2H2��g��![]() CH3OH��g����
CH3OH��g����
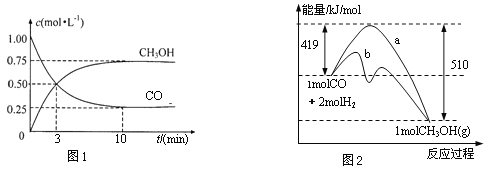
��1��ͼ1�DZ�ʾһ���¶��£������Ϊ2 L���ܱ������м���4 molH2��һ������CO����CO��CH3OH��g����Ũ����ʱ������������ӷ�Ӧ��ʼ��ƽ�⣬��COŨ�ȱ仯��ʾƽ����Ӧ���� v��CO��=_____________��H2��ƽ��ת����Ϊ_______________��
��2��ͼ2��ʾ�÷�Ӧ���й����������ı仯������a��ʾ��ʹ�ô���ʱ��Ӧ�������仯������b��ʾʹ�ô�����������仯��д����Ӧ������ѧ����ʽ:______________��
��3�����¶�������Ӧƽ�ⳣ��K=______________������ֵ����
��4�����������£����д�ʩ����ʹ��Ӧ��ϵ��![]() ����Ĵ�ʩ��____________��
����Ĵ�ʩ��____________��
A�������¶� B������He�� C���ٳ���2molH2 D��ʹ�ô���
���𰸡���1��0.075mol/��Lmin����75%��
��2��CO��g��+H2��g��![]() CH3OH��g�� ��H=-91kJ/mol����3��12����4��C��
CH3OH��g�� ��H=-91kJ/mol����3��12����4��C��
��������
�����������1������ͼ���֪��Ӧ���е�10minʱ�ﵽƽ��״̬����ʱ���ɼ״�0.75mol/L������ݷ���ʽ��֪����CO��Ũ����0.75mol/L��������CO��ʾ��ƽ����Ӧ����Ϊ0.75mol/L��10min��0.075 mol��L��1��min��1������������1.5mol/L����������ʼŨ����2mol/L�����������ת������![]() ��100%��75%��
��100%��75%��
��2������ͼ���֪��Ӧ����������������������������˷�Ӧ�Ƿ��ȷ�Ӧ����Ӧ�ȣ�419kJ/mol��510kJ/mol����91kJ/mol�����Ȼ�ѧ����ʽΪCO��g��+2H2��g��![]() CH3OH��g�� ��H����91 kJ��mol��1��
CH3OH��g�� ��H����91 kJ��mol��1��
��3��ƽ��ʱ����������Ũ����0.75mol/L ��2��1.5mol/L����������ʼŨ����4mol��2L��2mol/L������ƽ��ʱ����Ũ����0.5mol/L�������ͼ���֪ƽ�ⳣ��K��![]() ��
��
��4��A�������¶�ƽ�����淴Ӧ������У����ֵ��С��A����B�������ݻ��������He����ƽ�ⲻ�ƶ�������ֵ���䣬B����C���ٳ���2mol����ƽ��������Ӧ������У���˱�ֵ����C��ȷ��D���������ܸı�ƽ��״̬�����Ա�ֵ���䣬D����ѡC��


 ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����12�֣�ÿ��1�֣��±���Ԫ�����ڱ���һ���֣��ش������й����⣺
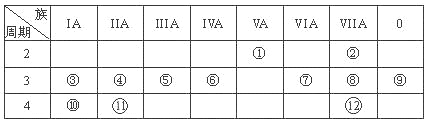
��1��д������Ԫ�ط��ţ��� ���� ���� ��
��2������ԭ�ӵĽṹʾ��ͼ���� ���� ��
��3������~Ԫ���У���������ǿ��Ԫ���� ���ǽ�������ǿ��Ԫ���� ������õ�Ԫ���� ��������Ԫ�ط��ţ�
��4��Ԫ������Ԫ������ȣ��ǽ����Խ�ǿ���� ����Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ���� ��
a�����������ĵ��ʺ����ĵ���״̬��ͬ b�������⻯��������⻯���ȶ�
c��һ���������������ĵ��ʶ���������������Һ��Ӧ
��5������������ԭ�Ӱ뾶����Ԫ���� ����Ԫ�ط��ű�ʾ��������ͬ���ڵ���AԪ���� ����Ԫ�ط��ű�ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ĵ���ƽ�⡢�����ˮ��ƽ�����������ܽ�ƽ���������ѧƽ�⡣����Ҫ��ش����}��
��1������������������ˮ��������ˮ��ԭ����_____________������������ʽ��ʾ����
��2�������£�ȡ0.2 mol/L HCl��Һ��0.2mol/L MOH��Һ�������������û����Һ���pH=5��д��MOH�ĵ��뷽��ʽ��__________________��
��3��0.1mol/L��NaHA��Һ�������Һ�Լ�������
�� ����Һ�� c��H2A��_______________c��A2-�����>��������<������ =��������
�� ���������жϵ�������_____________�������ֽ�������
��4����Cr2O72-�ķ�ˮ���Խϴ�ij������ˮ�к�5.0��10-3 mol/L��Cr2O72-��Ϊ��ʹ��ˮ�����Ŵ�꣬�������´�����
![]()
�̷�ΪFeSO4 7H2O����Ӧ��I����Cr2O72-��FeSO4����������֮��Ϊ___________��
��������������ķ�ˮ��c��Cr3+��=6.0��10-7mol/L��������ķ�ˮ�� pH=___________��{Ksp[Cr��OH�� 3]=6.0��10-31}
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ����������һ����ȷ���ǣ� ��
A. �����£�0.1mol/L��NH4NO3��Һ�е�ԭ����Ϊ0.2 NA
B. 1 mol�ǻ��еĵ�����Ϊ10 NA
C. �����£�1mol SiC�к���Si��C������ĿΪ4 NA
D. 28g����������Cl2��Ӧʱת�Ƶĵ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���ѧ����ͬϵ��������ͬ���������Dz�ͬ�ģ������й������������˵������ȷ����
A��ͬϵ��һ����ͬ������ B��ͬ������һ����ͬϵ��
C��ͬ�������п�����ͬ���칹�� D��ͬϵ�ﲻ������ͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о���ѧϰС��Ե������Һ�����µĹ����ܽᣨ���ڳ����£�����֪����ƽ�ⳣ����CH3COOH��H2CO3��C6H5OH ��HCO![]() �����в���ȷ����
�����в���ȷ����
A��pH��ȵ�������Һ��a��CH3COONab��C6H5ONac��NaHCO3d��NaOH����������Һ�����ʵ����ʵ���Ũ����С����˳��Ϊ��d<b<c<a
B��pH=8.3��NaHCO3��Һ��c(Na��)��c(HCO3��)��c(CO32��)��c(H2CO3)
C��pH��2��һԪ����pH��12�Ķ�Ԫǿ��������ϣ�c(OH��)��c(H��)
D��pH��4Ũ�Ⱦ�Ϊ0.1mol��L��1��CH3COOH��CH3COONa�����Һ�У�c(CH3COO��)��c(OH��)��c(CH3COOH)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��Ŀǰ����Ҫ��������������СCO2���ŷŲ�������������ֵ�Ļ�ѧ��Ʒ��Ŀǰ���о�Ŀ�ꡣ
��1������CO2��CH4�����ϳ���(CO��H2)��
��֪��CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ��H=��890.3 KJ��mol��1
CO2(g)+2H2O(g) ��H=��890.3 KJ��mol��1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H=+2.8 KJ��mol-1
CO2(g)+H2(g) ��H=+2.8 KJ��mol-1
2CO(g)+O2(g)![]() 2CO2(g) ��H=��566.0 KJ��mol��1
2CO2(g) ��H=��566.0 KJ��mol��1
��ӦCO2(g)+CH4(g)![]() 2CO(g)+2H2(g) ��H= ____________��
2CO(g)+2H2(g) ��H= ____________��
��250��ʱ�������Ͻ�Ϊ�����������Ϊ4 L���ܱ�������ͨ��6 mol CO2��6 mol CH4����ʼ�������·�Ӧ��CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)������һ��ʱ��ﵽƽ�⣬ƽ����ϵ�и�����������(ijһ�ɷ����ʵ���ռ���������ʵ����İٷ���)���±���
2CO(g)+2H2(g)������һ��ʱ��ﵽƽ�⣬ƽ����ϵ�и�����������(ijһ�ɷ����ʵ���ռ���������ʵ����İٷ���)���±���
���� | CH4 | CO2 | CO | H2 |
������� | 0.1 | 0.1 | 0.4 | 0.4 |
���¶��¸÷�Ӧ��ƽ�ⳣ��K=________________��
��2���Զ������ѱ��渲��Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�����������ڲ�ͬ�¶��´����Ĵ�Ч���������������������ͼ��ʾ��250��300��ʱ��������������ʼ�С������ԭ����____________________��

��3�� ������������ˮ��Һ������ʽ��е����CO2��ͭ�缫�Ͽ�ת��Ϊ�������õ缫��Ӧ����ʽΪ_____________________��
��4����2mol CO2��6molH2�ݻ���ͬ���¶Ȳ�ͬ�����������������ܱ������п�ʼ������Ӧ��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)�����CH3OH�����ʵ�����ʱ��ı仯����ͼ1��ʾ��
CH3OH(g)+H2O(g)�����CH3OH�����ʵ�����ʱ��ı仯����ͼ1��ʾ��


��������������Ӧ��ƽ�ⳣ����С��ϵΪK��_______K��(�>����=����<��)����֪�� ��Ӧ��һ��_______(��������������������)��Ӧ��
��������ʵ˵���÷�Ӧ�Ѵﵽƽ��״̬����_________________��
A������������ѹǿ���ֲ���
B��������������ܶȱ��ֲ���
C��CO2������������ֲ���
D��CO2������������CH3OH�������������
E�������ڻ�������ƽ����Է����������ֲ���
��5�����ù��ܺ�������ɽ�CO2��H2O(g)ת��ΪCH4��O2�����������ʱ���ڲ�ͬ����(����������)�����£�CH4���������ʱ��ı仯����ͼ2��ʾ����0��15Сʱ�ڣ�CH4��ƽ���������������������Ӵ�С��˳��Ϊ_____________(�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����NO�Ʊ�NH4NO3�Ĺ���ԭ����ͼ��ʾ��Ϊʹ������ȫ��ת��ΪNH4NO3����Ҫ��������M�������йط�����˵������ȷ������ ��
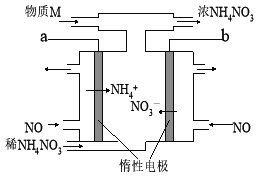
A��aӦ��ֱ����Դ������
B�������ĵ缫��Ӧʽ��NO+5e��+6H+��NH4++H2O
C����·��ͨ��5mol����ʱ�����������ɴ���22.4L����µ�NO
D�����������M��NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A������������������Ļ��������Ҵ���ȡ����
B��ֱ������������̼ԭ����Խ����е�Խ��
C��ͬ���칹�������������һ�����죬��ѧ���ʻ�����ͬ
D������̼̼˫��������ת���·����е�ԭ���ڿռ�����з�ʽ��ͬ���������칹��˳���칹
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com