
【题目】电化学原理在生产生活中应用十分广泛。请回答下列问题:
(1)通过SO2传感器可监测大气中SO2的含量,其工作原理如图所示。
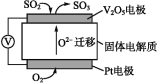
①固体电解质中O2向 (填“正”或“负”)极移动。
②写出V2O5电极的电极反应式: 。
(2)如图所示装置(Ⅰ)是一种可充电电池,装置(Ⅱ)是一种以石墨为电极的家用环保型消毒液发生器。装置(Ⅰ)中离子交换膜只允许Na+通过,充、放电的化学方程式为2Na2S2+NaBr3![]() Na2S4+3NaBr。
Na2S4+3NaBr。
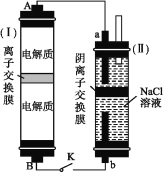
①负极区的电解质为 (用化学式表示)。
②家用环保型消毒液发生器发生反应的离子方程式为 。
③闭合开关K,当有0.04 mol Na+通过离子交换膜时,a电极上析出的气体在标准状况下的体积为
mL。
(3)下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“![]() +2I+2H+
+2I+2H+![]()
![]() +I2+H2O”设计成的原电池装置,其中C1、C2、C3、C4均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40% NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量浓盐酸或适量40% NaOH溶液,发现电流表指针都发生偏转。
+I2+H2O”设计成的原电池装置,其中C1、C2、C3、C4均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40% NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量浓盐酸或适量40% NaOH溶液,发现电流表指针都发生偏转。
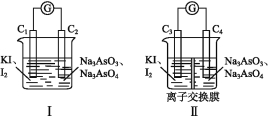
①甲组电流表指针都不发生偏转的原因是 。
②乙组添加的是 (填“阴”或“阳”)离子交换膜。
【答案】(14分,每空2分)
(1)①负 ②SO22e+O2![]() SO3
SO3
(2)①Na2S2、Na2S4
②Cl+H2O![]() ClO+H2↑ ③448
ClO+H2↑ ③448
(3)①氧化还原反应在电解质溶液中直接进行,没有电子沿导线通过 ②阳
【解析】(1)①原电池工作时,阴离子向负极移动。②V2O5电极上SO2转化为SO3,电极反应式为SO22e+O2![]() SO3。(2)①由原电池反应知放电时负极Na2S2转化为Na2S4,故负极区的电解质为Na2S2、Na2S4。②家用环保型消毒液发生器中a为阴极,电极反应为2H2O+2e
SO3。(2)①由原电池反应知放电时负极Na2S2转化为Na2S4,故负极区的电解质为Na2S2、Na2S4。②家用环保型消毒液发生器中a为阴极,电极反应为2H2O+2e![]() H2↑+2OH,b为阳极,电极反应为2Cl2e
H2↑+2OH,b为阳极,电极反应为2Cl2e![]() Cl2↑,产生的Cl2与阴极生成的OH反应:Cl2+2OH
Cl2↑,产生的Cl2与阴极生成的OH反应:Cl2+2OH![]() Cl+ClO+H2O,三式相加即可得总反应:Cl+H2O
Cl+ClO+H2O,三式相加即可得总反应:Cl+H2O![]() ClO+H2↑。③当有0.04 mol Na+通过离子交换膜时,a电极上析出0.02 mol H2,标准状况下其体积为0.02 mol×22.4 L·mol1=0.448 L=448 mL。(3)①甲组没添加离子交换膜,氧化还原反应在电解质溶液中直接进行,没有电子沿导线通过,故电流表指针不发生偏转。②当乙组向图Ⅱ烧杯右侧中加入浓盐酸时,C3为电池负极,电极反应为2I2e
ClO+H2↑。③当有0.04 mol Na+通过离子交换膜时,a电极上析出0.02 mol H2,标准状况下其体积为0.02 mol×22.4 L·mol1=0.448 L=448 mL。(3)①甲组没添加离子交换膜,氧化还原反应在电解质溶液中直接进行,没有电子沿导线通过,故电流表指针不发生偏转。②当乙组向图Ⅱ烧杯右侧中加入浓盐酸时,C3为电池负极,电极反应为2I2e![]() I2,C4为电池正极,电极反应为
I2,C4为电池正极,电极反应为![]() +2e+2H+
+2e+2H+![]()
![]() +H2O,为维持两侧溶液的电中性,阳离子需从烧杯左侧迁移至右侧,故中间的离子交换膜应为阳离子交换膜。当向烧杯右侧中加入40% NaOH溶液时,反应逆向进行,电流表指针偏转方向相反,阳离子从右侧通过阳离子交换膜迁移至左侧。
+H2O,为维持两侧溶液的电中性,阳离子需从烧杯左侧迁移至右侧,故中间的离子交换膜应为阳离子交换膜。当向烧杯右侧中加入40% NaOH溶液时,反应逆向进行,电流表指针偏转方向相反,阳离子从右侧通过阳离子交换膜迁移至左侧。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
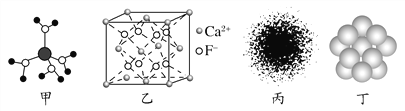
A. 水合铜离子的模型如图甲所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图乙所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图丙所示,H原子核外大多数电子在原子核附近运动
D. 金属Cu中Cu原子堆积模型如图丁所示,为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作对中和滴定结果没有影响的是
A.滴定管未用标准酸液或标准碱液润洗
B.锥形瓶用待测液润洗后加入待测液
C.锥形瓶洗净后未干燥
D.振荡时锥形瓶中液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在N2+3H22NH3的可逆反应中,自反应开始至2s末,氨的浓度由0变为0.8 molL﹣1 则以氢气的浓度变化表示该反应在2s内的平均反应速率是( )
A.0.3 molL﹣1S﹣1
B.0.4 molL﹣1S﹣1
C.0.6molL﹣1S﹣1
D.0.8 molL﹣1S﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题
(1)浓H2SO4能够用于干燥某些气体,是由于它具有性;下列气体能用浓硫酸来进行干燥的是(可多选,但只要有选错项,即得0分) ①Cl2②H2S ③CO2④NH3
(2)浓H2SO4能使纸片变黑,是由于它具有性;
(3)浓H2SO4可以与Cu反应,是由于它具有强氧化性和性,化学学方程式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施符合“绿色化学”思想的是
A. 直接排放含磷生活污水
B. 大量使用氟里昂作为冰箱制冷剂
C. 使用可降解塑料代替不可降解塑料
D. 使用化学性质稳定、不易分解的有机氯农药
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com