
【题目】苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
![]() +KMnO4→
+KMnO4→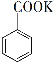 + MnO2
+ MnO2 +HCl→
+HCl→ +KCl
+KCl
名称 | 相对分 子质量 | 熔点/℃ | 沸点/℃ | 密度/(g·mL1) | 溶解性 |
甲苯 | 92 | 95 | 110.6 | 0.867 | 不溶于水,易溶于乙醇 |
苯甲酸 | 122 | 122.4(100℃左右开始升华) | 248 | —— | 微溶于冷水,易溶于乙醇、热水 |
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
(3)纯度测定:称取0. 122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25. 00 mL溶液,用0.01000 mol·L1的KOH标准溶液滴定,三次滴定平均消耗21. 50 mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为______(填标号)。
A.100 mL B.250 mL C.500 mL D.1000 mL
(2)在反应装置中应选用______冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是______。
(3)加入适量饱和亚硫酸氢钠溶液的目的是___________;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理__________。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是_______。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是_______。
(6)本实验制备的苯甲酸的纯度为_______;据此估算本实验中苯甲酸的产率最接近于_______(填标号)。
A.70% B.60% C.50% D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中__________的方法提纯。
【答案】B 球形 无油珠说明不溶于水的甲苯已经被完全氧化 除去过量的高锰酸钾,避免在用盐酸酸化时,产生氯气 2![]() +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O MnO2 苯甲酸升华而损失 86.0% C 重结晶
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O MnO2 苯甲酸升华而损失 86.0% C 重结晶
【解析】
甲苯用高锰酸钾氧化时生成苯甲酸钾和二氧化锰,为增加冷凝效果,在反应装置中选用球形冷凝管,加热回流,当回流液中不再出现油珠时,说明反应已经完成,加入适量的饱和亚硫酸氢钠溶液除去过量的高锰酸钾,用盐酸酸化得苯甲酸,过滤、干燥、洗涤得粗产品;用KOH溶液滴定,测定粗产品的纯度。
(1)加热液体,所盛液体的体积不超过三颈烧瓶的一半,三颈烧瓶中已经加入100m的水,1.5mL甲苯,4.8g高锰酸钾,应选用250mL的三颈烧瓶,故答案为:B;
(2)为增加冷凝效果,在反应装置中宜选用球形冷凝管,当回流液中不再出现油珠时,说明反应已经完成,因为:没有油珠说明不溶于水的甲苯已经完全被氧化;故答案为:球形;没有油珠说明不溶于水的甲苯已经完全被氧化;
(3)高锰酸钾具有强氧化性,能将Cl-氧化。加入适量的饱和亚硫酸氢钠溶液是为了除去过量的高锰酸钾,避免在用盐酸酸化时,产生氯气;该步骤亦可用草酸处理,生成二氧化碳和锰盐,离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;故答案为:除去过量的高锰酸钾,避免在用盐酸酸化时,产生氯气;5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(4)由信息甲苯用高锰酸钾氧化时生成苯甲酸钾和二氧化锰,“用少量热水洗涤滤渣”一步中滤渣的主要成分是:MnO2,故答案为:MnO2;
(5)苯甲酸100℃时易升华,干燥苯甲酸时,若温度过高,苯甲酸升华而损失;故答案为:苯甲酸升华而损失;
(6)由关系式C6H5COOH~KOH得,苯甲酸的纯度为: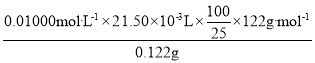 ×100%=86.0%;1.5mL甲苯理论上可得到苯甲酸的质量:
×100%=86.0%;1.5mL甲苯理论上可得到苯甲酸的质量:![]() =1.72g,产品的产率为
=1.72g,产品的产率为![]() ×100%=50%;故答案为:86.0%;C;
×100%=50%;故答案为:86.0%;C;
(7)提纯苯甲酸可用重结晶的方法。故答案为:重结晶。


科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是

A.该装置工作时,H+从a极区向b极区迁移
B.该装置将化学能转化为光能和电能
C.a电极的反应式为3CO2+18H+-18e-=C3H8O+5H2O
D.每生成3 mol O2,有88 g CO2被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 0.1 mol·L-1的ZnCl2溶液中通入足量H2S,最终得不到ZnS沉淀是因为溶液中:c(Zn2+)·c(S2-)<Ksp(ZnS)
B. 根据Ksp(AgCl)=1.77×10-10,Ksp(Ag2CrO4)=1.12×10-12,可以推知AgCl的溶解度比Ag2CrO4的溶解度大
C. 向AgCl与AgNO3的浊液通入少量H2S,有黑色沉淀生成,则Ksp(AgCl)> Ksp(Ag2S)
D. 向碳酸钡沉淀中加入稀硫酸,沉淀发生转化,可推知硫酸钡的Ksp比碳酸钡的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.常温常压下,28gCO与N2的混合气体所含有的原子数为2NA
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1
C.同温同压下,相同质量的二氧化碳和二氧化硫的体积是16:11
D.常温常压下,0.5×6.02×1023一氧化碳分子所占体积是11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组,在做Na2O2与水反应实验时,发现Na2O2与水反应后的溶液中滴加酚酞试液溶液呈现红色,但红色很快褪色,甲、乙、丙三同学对此现象分别做了如下推测:
甲:因为反应后试管很热,所以可能是溶液温度较高使红色褪去。
乙:因为所加水的量较少,红色褪去可能是生成的NaOH溶液浓度较大的影响。
丙:Na2O2具有强氧化性,生成物中O2、H2O(可能产物)等也具有强氧化性,氧化漂白了红色物质。
(1)验证甲同学的推测是否正确的方法是_________,验证乙同学的推测是否正确的方法是_________,当出现_________现象时,即说明丙同学的推测正确。
(2)有同学提出用定量的方法探究丙同学方案中是否含有出O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论。
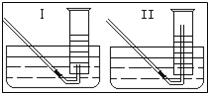
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的_______,理由是________。
②若在标准状况下测量气体的体积,应选用量筒的大小规格为______(选填“l00mL”、“200mL”、“500mL”或“l000mL”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京奥运会主体育场“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884 块ETFE 膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是

A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga 处于IIIA 族,可推知氮化镓化学式为GaN
C.用金属铝与V2O5反应冶炼钒,V2O5作还原剂
D.ETFE 膜(![]() )是由一种单体加聚而成的
)是由一种单体加聚而成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是一种重要的医药中间体,其合成路线如图:

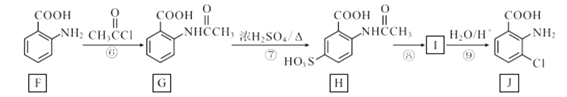
回答下列问题:
(1)G中官能团的名称是__;③的反应类型是__。
(2)通过反应②和反应⑧推知引入—SO3H的作用是__。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出F与足量氢气反应生成产物的结构简式,并用星号(*)标出其中的手性碳__。
(4)写出⑨的反应方程式__。
(5)写出D的苯环上有三个不相同且互不相邻的取代基的同分异构体结构简式_。
(6)写出以对硝基甲苯为主要原料(无机试剂任选),经最少步骤制备含肽键聚合物的合成路线__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与NaOH醇溶液共热完全反应后,可得3种有机物的是( )
A.CH3﹣CHCl﹣CH2﹣CH3
B.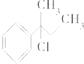
C.CH3﹣C(CH3)Cl﹣CH2﹣CH3
D.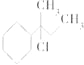
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com