
| A. | 无论使用的石油、煤等传统能源,还是氢能、核能等新能源,归根结底这些能源都是由太阳能转而来 | |
| B. | 铝表面有一层致密的氧化物薄膜具有极强的抗腐蚀能力,故铝制容器可用来贮存酸碱性、腌制性食品等 | |
| C. | 生活中用草木灰制作松花蛋,农业上用福尔马林浸种,工业上用亚硝酸盐处理皮革等,其过程的共同点都是利用了蛋白质变性的性质 | |
| D. | 氯气、次氯酸盐、二氧化氯等含氯化合物都具有强氧化性,能用于杀菌消毒.氯化钾、氯酸钾也是含氯化合物,故也能用于杀菌消毒 |
分析 A、煤是由远古时代的植物转化而来,石油是由远古时代的动物转化而来;
B、氯离子会破坏铝表面氧化膜;
C、草木灰中含K2CO3;
D、氯化钾无强氧化性.
解答 解:A、煤是由远古时代的植物转化而来,石油是由远古时代的动物转化而来,而动物归根结底是吃植物而生长的,而地球上元素种类和原子个数守恒,故石油、煤和氢能、核能等是由太阳能转化而来,故A正确;
B、氯离子会破坏铝表面氧化膜,则不能用铝制容器来腌制咸菜等,故B错误;
C、草木灰中含K2CO3,能使蛋白质盐析而不是变性,故C错误;
D、氯化钾无强氧化性,不能用于杀菌消毒,故D错误.
故选A.
点评 本题考查了能源的来源和蛋白质变性和盐析等性质,难度不大,应注意的是重金属盐会导致蛋白质的变性.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
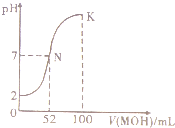 常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | N点水的电离程度小于K点水的电离程度 | |
| C. | 在K点,c(M+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | K点对应的溶液中,有c( MOH)+c( M+)=0.02 mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
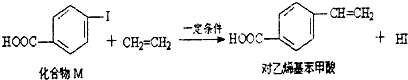
| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸即属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | 原子半径由小到大的顺序为X<Y<Z<W | |
| B. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| C. | X、Z两种元素的氧化物中所含化学键类型相同 | |
| D. | Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物更加稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com