
富马酸亚铁(分子式为C4H2O4Fe,结构简式为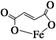 )是一种限量使用的铁强化剂。
)是一种限量使用的铁强化剂。
(1)下图为实验室模拟工业制取富马酸亚铁的流程图:
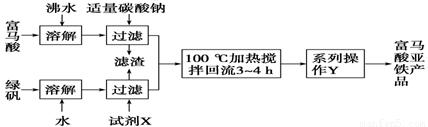
①根据题意,请你写出富马酸的结构简式:________________________。
②绿矾(FeSO4·7H2O)在保存过程中形成的杂质主要有________(填化学式)。
③操作Y包括________、冷却结晶、过滤、洗涤、干燥等。
④判断操作Y中“洗涤”富马酸亚铁产品表明已洗净的实验方法是___________。
(2)设计一个实验方案,证明所得富马酸亚铁产品属于亚铁盐(可供选用的试剂有KSCN溶液、H2O2溶液、稀硫酸。)。填写下表相应空格:
|
步骤 |
实验操作与现象 |
|
① |
取富马酸亚铁产品1.5 g,加入稀硫酸25 mL,用水稀释至50 mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液 |
|
② |
|
|
③ |
|
(1)①HOOCHC===CHCOOH
②Fe2(SO4)3和Fe(OH)3
③蒸发浓缩
④取洗涤液,向其中加入少量盐酸酸化后再加入氯化钡溶液,无白色沉淀生成
(2)②取少量滤液,滴加KSCN溶液,不显血红色
③再向上述溶液中滴加H2O2溶液,溶液显血红色
【解析】
试题分析:(1)①由富马酸亚铁的结构简式可推断富马酸的结构简式为HOOCHC===CHCOOH,②由于亚铁离子不稳定,容易被氧化成三价铁离子,铁离子在溶液中会发生水解,生成氢氧化铁,所以绿矾(FeSO4•7H20)在保存过程中形成的杂质主要有硫酸铁、氢氧化铁等杂质③得到的含有富马酸亚铁的溶液需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,最后得到富马酸亚铁产品;④富马酸亚铁表面的可溶性杂质离子有Na+、SO42-等,可以从检验洗涤液中是否含Na+或SO42-来设计实验.所以检验方法是:取最后一次洗涤液,先加入稀盐酸,再加入氯化钡溶液,无白色沉淀生成,说明已洗涤干净.
(2)检验亚铁离子的方法:滴加硫氰化钾溶液,溶液没有变成红色,证明溶液中没有三价铁离子;然后加入氧化剂将亚铁离子氧化成三价铁离子,溶液变成红色,证明原溶液中存在亚铁离子,结合题给试剂故答案为:
|
步骤 |
实验操作与现象 |
|
① |
取富马酸亚铁产品1.5 g,加入稀硫酸25 mL,用水稀释至50 mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液 |
|
② |
取少量滤液,滴加KSCN溶液,不显血红色 |
|
③ |
再向上述溶液中滴加H2O2溶液,溶液显血红色 |
考点:本题以实验室模拟工业制取富马酸亚铁为载体,考查了有机物结构简式的书写、Fe3+的水解性、Fe2+的还原性及检验知识.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:阅读理解
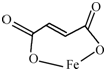 是一种可限量使用的铁强化剂
是一种可限量使用的铁强化剂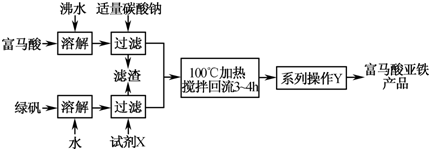
| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品l.5g,加入稀硫酸25mL,用水稀释至50ml,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液. |
| ② | 取少量滤液,滴加KSCN溶液,不显红色 取少量滤液,滴加KSCN溶液,不显红色 |
| ③ | 取酸性高锰酸钾溶液适量,向其中滴加滤液至溶液褪色 取酸性高锰酸钾溶液适量,向其中滴加滤液至溶液褪色 |
| ④ | 取上述褪色后的溶液,滴加KSCN溶液显红色 取上述褪色后的溶液,滴加KSCN溶液显红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 分子式 | 相对分子质量 | 溶解度和溶解性 | 酸性 |
| H4C4O4 | 116 | 在水中:0.7g(25℃)、9.8g(97.5℃). 盐酸中:可溶. |
二元酸,且0.1mol/L H4C4O4的pH=2. |
| 开始沉淀时的pH | 完全沉淀时的pH |
| 7.6 | 9.6 |
查看答案和解析>>
科目:高中化学 来源:江苏模拟题 题型:实验题
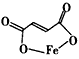 )是一种可限量使用的铁强化剂。
)是一种可限量使用的铁强化剂。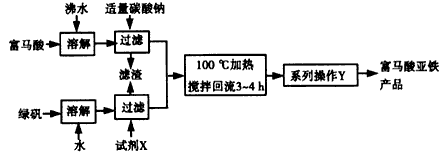

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
富马酸亚铁FeH2C4O4,商品名富血铁,含铁量高,是治疗缺铁性贫血常见的药物。某校研究性学习小组通过查阅大量资料后,决定自行制备富血铁并检测其含铁量。
富马酸(HOOC-CH=CH-COOH)的性质:
| 分子式 | 相对分子质量 | 溶解度和溶解性 | 酸性 |
| H4C4O4 | 116 | 在水中:0.7g(25℃)、9.8g (97.5℃)。 盐酸中:可溶。 | 二元酸,且0.1mol/LH4C4O4的pH=2。 |
Fe2+的性质:
| 开始沉淀时的pH | 完全沉淀时的pH |
| 7.6 | 9.6 |
I、富马酸亚铁的制备
①将适量的富马酸置于100ml烧杯中,加水20ml在热沸搅拌下,加入Na2CO3溶液10ml,使其pH为6.5~6.7;
②将上述溶液转移至100ml圆底烧瓶中,装好回流装置,加热至沸;
③缓慢加入新制的FeSO4溶液30ml,维持温度100℃,充分搅拌1.5小时。
④冷却、过滤,洗涤沉淀,然后水浴干燥,得到棕色粉末。
试回答:
步骤①中加入Na2CO3 ,反应的离子方程式_____________(富马酸及其酸根用化学式表示)。
步骤①中反应后控制溶液pH为6.5~6.7;若反应后溶液的pH太小,则引起的后果是_____________。若反应后溶液的pH太大则引起的后果是__________________。
II 产品纯度测定
准确称取富血铁0.3200g,加煮沸过的3mol/LH2SO4溶液15ml,待样品完全溶解后,加煮沸过的冷水50ml和4滴邻二氮菲-亚铁指示剂,立即用(NH4)2Ce(SO4)3(硫酸高铈铵)0.1000mol/L标准溶液进行滴定。直至溶液刚好变为浅蓝色即为终点。测得其体积为18.50mL,计算样品中富血铁的质量分数,写出计算过程。(Fe2+ +Ce4+=Fe3+ + Ce3+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com