
煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用 煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)=2CO2(g) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
则反应CO(g)+2H2(g)=CH3OH(g)的ΔH=______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。
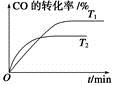
①T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
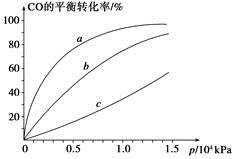
②由CO合成甲醇时,CO在250 ℃、300 ℃、350 ℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为________ ℃。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是____________。
③以下有关该反应的说法正确的是________(填序号)。
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2 mol CO和6 mol H2充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)一定温度下,向2 L固定体积的密闭容器中加入1 mol CH3OH(g),发生反应:CH3OH(g)  CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
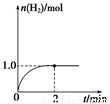
0~2 min内的平均反应速率v(CH3OH)=__________。该温度下,反应CO(g)+2H2(g)  CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
A.平衡常数 B.CH3OH的平衡浓度
C.达到平衡的时间 D.平衡时气体的密度
(1)ΔH1+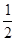 ΔH2-
ΔH2-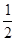 ΔH3
ΔH3
(2)①> ②350 1.3×104 kPa下CO的转化率已经很高,如果增大压强,CO的转化率提高不大,而生产成本增加很多,得不偿失 ③AD
(3)0.125 mol·L-1·min-1 4 D
【解析】(1)根据盖斯定律可得,ΔH=ΔH1+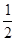 ΔH2-
ΔH2-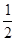 ΔH3。(2)①由图可知,T2>T1,温度升高CO的转化率降低,说明正反应为放热反应,温度升高时K降低,所以K1>K2。②曲线c的转化率最低,则其对应的温度最高,所以曲线c所表示的温度为350 ℃。1.3×104 kPa下CO的转化率已经很高,如果增大压强,CO的转化率提高不大,而生产成本增加很多,得不偿失。③A项,由于CO(g)+2H2(g)
ΔH3。(2)①由图可知,T2>T1,温度升高CO的转化率降低,说明正反应为放热反应,温度升高时K降低,所以K1>K2。②曲线c的转化率最低,则其对应的温度最高,所以曲线c所表示的温度为350 ℃。1.3×104 kPa下CO的转化率已经很高,如果增大压强,CO的转化率提高不大,而生产成本增加很多,得不偿失。③A项,由于CO(g)+2H2(g)  CH3OH(g)为反应前后气体体积不相等的反应,所以当其达到平衡时,体系的压强才保持不变,对;B项,H2与CO均为反应物,在未达到平衡时H2的消耗速率也是CO的消耗速率的2倍,错;C项,使用合适的催化剂能缩短达到平衡的时间,但不能提高CH3OH的产率,错;D项,CO起始浓度为1 mol·L-1,平衡后为0.2 mol·L-1,则转化0.8 mol·L-1,转化率为80%,对。(3)0~2 min内n(H2)的改变量为1.0 mol,浓度的变化量为0.5 mol·L-1,则v(H2)=0.25 mol·L-1·min-1,v(CH3OH)=0.125 mol·L-1·min-1;各物质的平衡浓度分别为c(H2)=0.5 mol·L-1,c(CO)=0.25 mol·L-1,c(CH3OH)=0.25 mol·L-1,则反应CH3OH(g)
CH3OH(g)为反应前后气体体积不相等的反应,所以当其达到平衡时,体系的压强才保持不变,对;B项,H2与CO均为反应物,在未达到平衡时H2的消耗速率也是CO的消耗速率的2倍,错;C项,使用合适的催化剂能缩短达到平衡的时间,但不能提高CH3OH的产率,错;D项,CO起始浓度为1 mol·L-1,平衡后为0.2 mol·L-1,则转化0.8 mol·L-1,转化率为80%,对。(3)0~2 min内n(H2)的改变量为1.0 mol,浓度的变化量为0.5 mol·L-1,则v(H2)=0.25 mol·L-1·min-1,v(CH3OH)=0.125 mol·L-1·min-1;各物质的平衡浓度分别为c(H2)=0.5 mol·L-1,c(CO)=0.25 mol·L-1,c(CH3OH)=0.25 mol·L-1,则反应CH3OH(g)  ?CO(g)+2H2(g)的
?CO(g)+2H2(g)的
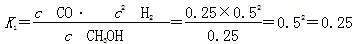
而反应CO(g)+2H2(g)  CH3OH(g)的平衡常数K=1/K1=1/0.25=4。
CH3OH(g)的平衡常数K=1/K1=1/0.25=4。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源:2014高考名师推荐化学可充电池的反应规律(解析版) 题型:选择题
固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体。这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体。目前固体电解质在制造全固态电池及其他传感器、探测器等方面的应用日益广泛。如RbAg4I5晶体,其中迁移的物种全是Ag+,室温导电率达0.27 Ω-1·cm-1。利用RbAg4I5晶体,可以制成电化学气敏传感器。下图是一种测定O2含量的气体传感器示意图,被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知O2的含量。在气体传感器工作过程中,下列变化肯定没有发生的是
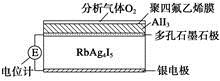
A.I2+2Rb++2e-=2RbIB.I2+2Ag++2e-=2AgI
C.Ag-e-=Ag+D.4AlI3+3O2=2Al2O3+6I2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学用语与分类(解析版) 题型:选择题
下列各项说法正确的是
①氢氧化铁胶体中,H+、K+、S2-、Br-能大量共存
②向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
③沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
④明矾能水解生成Al(OH)3胶体,可用作净水剂
⑤向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
A.②④ B.②③⑤ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡常数(解析版) 题型:选择题
在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I(aq)。测得不同温度下该反应的平衡常数K如表所示,下列说法正确的是
t/℃ | 5 | 15 | 25 | 35 | 50 |
K | 1 100 | 841 | 689 | 533 | 409 |
A.反应I2(aq)+I-(aq) I(aq)的ΔH>0
I(aq)的ΔH>0
B.其他条件不变,升高温度,溶液中c(I)减小
C.该反应的平衡常数表达式为K=
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡常数、等效平衡(解析版) 题型:填空题
在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g)  3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
(1)达到平衡时,C在反应混合气中的体积分数是 (用含字母a的代数式表示)。
(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为 mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比 (选填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入C mol。
(4)在同一容器中加nmolA和3n molB,则平衡时C的物质的量为mmol,若改变实验条件,可以使C的物质的量在m~2m间变化,那么,n与m的关系是_____________。(用字母n、m关系式表示)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡图像(解析版) 题型:实验题
某校学生化学实验小组,为验证非金属元素氟的氧化性强于硫和氮,设计了一套实验装置:(部分加持装置已略去)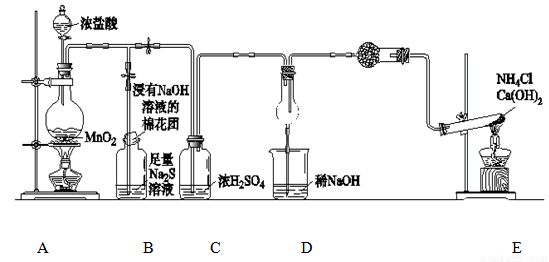
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)试从原子结构角度解释氯的氧化性大于硫的原因 。
(4)D中干燥管中出现的现象及化学方程式 。
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请画出其装置图 (并注明盛装试剂)。
(6)还有什么方法能证明氧化性Cl2>S,用一种相关事实说明 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡图像(解析版) 题型:选择题
温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生PCl5(g)  PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是
PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是
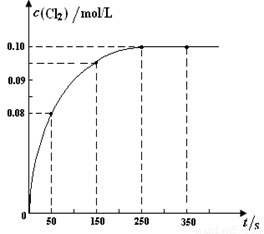
A.反应在0 ~50 s 的平均速率v(Cl2) =1.6×10-3mol/(L·s)
B.该温度下,反应的平衡常数K = 0.025
C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则该反应的ΔH <0
D.反应达平衡后,再向容器中充入 1 mol PCl5,该温度下再达到平衡时,0.1 mol/L<c(Cl2)<0.2 mol/L
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学实验的基本操作(解析版) 题型:选择题
实验室保存下列试剂,其中保存方法和理由描述都正确的是
编号 | 试剂 | 保存方法 | 理由 |
A | 钠 | 保存在煤油中 | 防止与空气中水、氧气接触发生反应 |
B | 液溴 | 密封保存在细口瓶中 | 防止升华 |
C | 浓硝酸 | 密封保存在铁器中 | 避免见光分解 |
D | 烧碱 | 存放在磨口玻璃塞的广口瓶中 | 防止与空气中氧气接触被氧化 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学元素周期律及化学键(解析版) 题型:选择题
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则
A、原子半径:丙>丁>乙
B、单质的还原性:丁>丙>甲
C、甲、乙、丙的氧化物均为共价化合物
D、乙、丙、丁的最高价氧化物对应的水化物不能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com