
| A. | SO42-、CO32-、F- | B. | CO32-、SO42-、F- | C. | CO32-、F-、SO42- | D. | F-、CO32-、SO42- |
分析 析出沉淀时,CaSO4溶液中c(Ca2+)=$\frac{{K}_{sp}(CaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$=$\frac{9.0×1{0}^{-6}}{0.010}$mol/L,CaCO3溶液中c(Ca2+)=$\frac{{K}_{sp}(CaC{O}_{3})}{c(C{{O}_{3}}^{2-})}$=$\frac{5.0×1{0}^{-9}}{0.010}$mol/L,CaF2溶液中c(Ca2+)=$\frac{1.5×1{0}^{-10}}{0.01{0}^{2}}$mol/L,c(Ca2+)越小,则越先生成沉淀,据此进行判断.
解答 解:析出沉淀时,CaSO4溶液中c(Ca2+)=$\frac{{K}_{sp}(CaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$=$\frac{9.0×1{0}^{-6}}{0.010}$mol/L=9.0×10-4mol/L,CaCO3溶液中c(Ca2+)=$\frac{{K}_{sp}(CaC{O}_{3})}{c(C{{O}_{3}}^{2-})}$=$\frac{5.0×1{0}^{-9}}{0.010}$mol/L=5.0×10-7mol/L,CaF2溶液中c(Ca2+)=$\frac{1.5×1{0}^{-10}}{0.01{0}^{2}}$mol/L=1.5×10-6mol/L,c(Ca2+)越小,则越先生成沉淀,所以三种阴离子产生沉淀的先后顺序为CO32-、F-、SO42-,
故选C.
点评 本题考查难溶电解质的溶解平衡的计算与判断,题目难度中等,注意根据溶解度判断生成沉淀的先后顺序,需要明确组成不相似的物质,不能直接根据溶度积判断,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 用高锰酸钾溶液滴定Na2SO3溶液至终点,滴入最后一滴高锰酸钾溶液,溶液颜色恰好由紫红色变为无色且半分钟不变色 | |
| B. | 燃料电池制作的实验中,石墨棒用海绵包裹是为了更好的固定电极 | |
| C. | pH试纸在检测溶液时不能湿润,使用石蕊试纸检测气体时需要湿润并粘在洁净玻璃棒的一端 | |
| D. | 海带中提取碘,可将灰化后的海带加水煮沸一段时间后过滤,在滤液中加入稀硫酸后转移到分液漏斗中用CCl4萃取分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH |  |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:
.H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
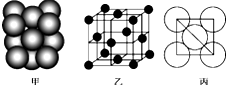 铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示.
铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “神七”登天标志着我国的航天事业进入了新的篇章.
“神七”登天标志着我国的航天事业进入了新的篇章.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜丝插入浓硫酸加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色 | |
| B. | 常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 | |
| C. | 金属钠放入硫酸铜溶液中可以置换出金属铜 | |
| D. | 将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯分子中含碳碳双键 | B. | 以淀粉为原料可制取乙酸乙酯 | ||
| C. | 戊烷有3种同分异构体 | D. | 油脂的皂化反应属于水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com