
【题目】某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
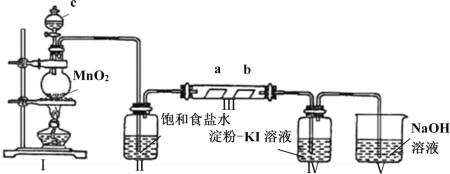
(1)装置Ⅰ中仪器c的名称是_______________,实验室以二氧化锰和浓盐酸制备氯气的离子方程式为_______________________________________________________。
(2)装置Ⅱ的作用是________________________。
(3)实验过程中装置Ⅳ中的实验现象为______________________________。
(4)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置Ⅱ与III之间添加下图中的_______装置(填序号)。

(5)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式___________________。
【答案】分液漏斗 MnO2+4H++2Cl–![]() Mn2++Cl2↑+2H2O 除去氯气中的氯化氢气体 无色溶液变为蓝色 ④ Cl2+2OH–=Cl–+ClO–+H2O
Mn2++Cl2↑+2H2O 除去氯气中的氯化氢气体 无色溶液变为蓝色 ④ Cl2+2OH–=Cl–+ClO–+H2O
【解析】
(1)装置Ⅰ中仪器c的名称是分液漏斗,实验室以二氧化锰和浓盐酸制备氯气的离子方程式为MnO2+4H++2Cl–![]() Mn2++Cl2↑+2H2O;答案:分液漏斗;MnO2+4H++2Cl–
Mn2++Cl2↑+2H2O;答案:分液漏斗;MnO2+4H++2Cl–![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)装置Ⅱ中盛有饱和食盐水,因为浓盐酸具有挥发性,则制取的氯气中混有氯化氢,用饱和食盐水可以除去杂质氯化氢,因此,答案是:除去氯气中的氯化氢气体。
(3)氯气具有氧化性,能够与碘化钾溶液反应生成碘单质,所以装置Ⅳ中通入氯气后,无色溶液变蓝色,因此,答案是:无色溶液变蓝色。
(4)干燥的氯气不具有漂白性,Ⅱ和Ⅲ之间可加干燥装置,除去氯气中的水蒸气,根据氯气的化学性质可知,应选浓硫酸作干燥剂,本题正确答案是:④ 。
(5)装置Ⅴ盛放的是氢氧化钠溶液,目的是防止尾气污染空气,反应的化学方程式为: Cl2+2OH–=Cl–+ClO–+H2O ,因此,答案是: Cl2+2OH–=Cl–+ClO–+H2O 。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.汽车尾气中含有NO、CO等有害物质,其中NOx会引起光化学烟雾等环境问题。
NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3或尿素将尾气中NOx还原为N2从而降低污染。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因 _________________(用化学方程式表示,该反应为为可逆反应);汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因 _____________________________。
(2)①NH3去除尾气中的NOx,当v(NO):v(NO2)=1:1时称为“快速SCR 反应”,该反应化学方程式为______________________________________ ;
②合成NH3所用原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+![]() O2 (g)== CO2 (g) △H1=-282.0 KJ/mol
O2 (g)== CO2 (g) △H1=-282.0 KJ/mol
H2(g)+![]() O2 (g)=== H2O (g) △H2=-241.8 KJ/mol
O2 (g)=== H2O (g) △H2=-241.8 KJ/mol
CH4(g)+ 2O2 (g)== CO2 (g)+ 2H2O (g) △H3=-836.3 KJ/mol
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为___________。
(3)通过NOx传感器可监测NOx的含量,其工作原理如图所示,则:
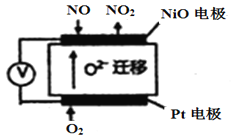
①Pt电极上发生的是 ______________反应(填“氧化”或“还原”);
②NiO电极上的电极反应式为______________________________________;
(4)研究发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,测得不同时间容器内的压强(p)与起始压强(p0)的比值(p/p0)如下表。
时间/t | 0min | 2min | 5min | 10min | 13min | 15min |
比值(p/p0) | 1 | 0.97 | 0.925 | 0.90 | 0.90 | 0.90 |
0~5min内,该反应的平均反应速率V(NO)=___________________;
(5)将上述反应的CO2与NH3为原料合成尿素,能够实现节能减排:①2NH3(g)+CO2(g)=NH2CO2NH4span>(s);②NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为aPa,若反应温度不变,将体系的体积增加50%,至达新平衡的过程中P[H2O(g)]的取值范围是__________________ (用含a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A. 质子数与中子数相等的硫原子:![]() S B. Al3+的结构示意图:
S B. Al3+的结构示意图: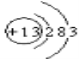
C. CaO2的电子式:![]() D. 2-溴丙烷的结构简式:C3H7Br
D. 2-溴丙烷的结构简式:C3H7Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及其化合物(或溶液)的转化关系,已知单质B2、C2、D2、E2在常温常压下都是气体,化合物G的焰色反应为黄色;化合物I、J、K通常状况下呈气态。下列说法正确的是

A. B氢化物的沸点高于其同主族其它元素氢化物的沸点
B. 原子半径大小:A>C>B>E>D
C. F中既含有离子键又含有极性共价键
D. G中的阴离子能抑制水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
Ⅰ.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,Pb3O4与HNO3发生非氧化还原反应生成一种盐和一种铅氧化物,其反应的化学方程式为_____________。
Ⅱ.以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:

(2)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4生成1molPbSO4转移电子的物质的量为____________mol。
(3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示:
NaHPbO2(aq),其溶解度曲线如图所示:

②粗品PbO中所含杂质不溶于NaOH溶液。
结合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量__________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,__________,将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl2的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。

①阴极的电极反应式为_______________________。
②电解一段时间后,Na2PbCl4浓度极大减小,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)用甲烷与水蒸气制备合成气,每生成1mol合成气,需要供给51.5 kJ热量。该反应的热化学方程式为_____________________________________________________。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),发生反应: CH4(g) + H2O(g) ![]() CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
时间/min 物质的浓度(mol/L) | 0 | 1 | 2 | 3 | 4 |
CH4 | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
H2 | 0 | 0.21 | 0.3 | 0.3 | 0.33 |
①该反应第一次达平衡时的平衡常数K=_______________。
②3min时改变的反应条件是__________________(只填一种条件的改变即可)。
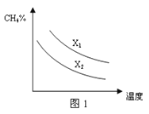
(3)已知一定压强下,温度、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。图1中的两条曲线所示投料比的关系X1 ______X2(填“=”、“>”或“<”)。
Ⅱ.(4)已知常温下HCOOH的电离常数为![]() ,则HCOO—的水解反应HCOO- + H2O
,则HCOO—的水解反应HCOO- + H2O ![]() HCOOH + OH-的平衡常数K h =__________________。
HCOOH + OH-的平衡常数K h =__________________。
(5)常温下,将a mol/L的HCOOH溶液与a/2mol/L的NaOH溶液等体积混合后,溶液中各离子浓度由大到小的顺序是______________________________。
(6)常温下,在a mol/L的HCOOH溶液中加入等体积的bmol/L的NaOH溶液至溶液呈中性,此时溶液中HCOOH的物质的量浓度为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6 g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入22.4 L的CO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com