
【题目】在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
A. K+、Cu2+、NO3-、Cl-
B. K+、Na+、NO3-、CO32-
C. Na+、H+、NO3-、SO42-
D. Fe3+、Na+、Cl-、SO42-
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl–,消耗等物质的量浓度的AgNO3溶液的体积比为1:1:1,则上述溶液的体积比为( )
A. 1:1:1 B. 6:3:2 C. 3:2:1 D. 9:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 量筒量取20.0mL 0.500 mol·L-1 H2SO4溶液于烧杯中,加80 mL水配制成0.100 mol·L-1H2SO4溶液 B. 用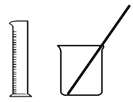 配制100 mL 0.100 0 mol·L-1 KMnO4溶液
配制100 mL 0.100 0 mol·L-1 KMnO4溶液
C. 固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 D. 1 g 98%的浓硫酸加4 g水配制成19.6%的硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中可能大量存在的一组离子是( )
A. H+、Cl﹣、PO43﹣、Na+ B. H+、Fe2+、SO42﹣、NO3﹣
C. K+、H+、NO3﹣、Na+ D. OH﹣、Br﹣、SO42﹣、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比
A. 5:2 B. 3:1 C. 15:2 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一份NaOH溶液分成两等份后,分别用pH=2和pH=3的醋酸溶液完全中和,设消耗醋酸溶液的体积依次是Va L和Vb L,则Va和Vb之间的关系是( )
A.Va>10Vb
B.Vb=10Va
C.Vb<10Va
D.Vb>10Va
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系: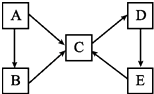
(1)若A为单质,C、D的相对分子质量相差16,0.05 molL﹣1 E溶液中只有3种离子,且在25℃时,溶液中的 ![]() =1012 . ①若B为气态氢化物,写出E→C的一个化学方程式 .
=1012 . ①若B为气态氢化物,写出E→C的一个化学方程式 .
②在A→C的反应中,每转移1 mol e﹣就会放热143.5 kJ,写出该反应的热化学方程式 .
(2)若A为单质,B、C均属于盐类,D是一种白色沉淀.①若B的水溶液呈酸性,C的水溶液呈碱性,C溶液呈碱性的原因是(用离子方程式表示).
②若B溶液呈黄色,与硫氰化钾溶液混合后显红色,E是一种不溶性碱.则:
(Ⅰ)B→C的离子方程式为 .
(Ⅱ)D→E的化学方程式为 .
(Ⅲ)选用一种试剂R与E反应实现E→C的转化,则R为;该反应的离子方程式为 .
(3)若A~E均为化合物,且均含有元素Y.A是淡黄色固体,B、C两溶液在等物质的量浓度时,C溶液的pH较小.电解D的水溶液是最重要的工业生产之一,D→E→C也是工业制备C的普遍方法.Y的单质与钾的合金可在核反应堆中用作热交换液.5.05 g Y钾合金溶于200 mL水生成0.075 mol氢气,计算并确定该Y钾合金的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里存在重要的酸碱平衡:CO2+H2OH2CO3 ![]() HCO3﹣ , 使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒.其pH随c(HCO3﹣):c(H2CO3)变化关系如下表:
HCO3﹣ , 使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒.其pH随c(HCO3﹣):c(H2CO3)变化关系如下表:
c(HCO | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是( )
A.正常人体血液中,HCO ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B.人体血液酸中毒时,可注射NaHCO3溶液缓解
C.pH=7.00的血液中,c(H2CO3)<c(HCO ![]() )
)
D.pH=7.40的血液中,HCO ![]() 的水解程度一定大于H2CO3的电离程度
的水解程度一定大于H2CO3的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物中碳原子和氢原子个数比为3:4,不能与溴水反应却能使酸性KMnO4溶液褪色.其蒸气密度是相同状况下甲烷密度的7.5倍.在铁存在时与溴反应,能生成两种一溴代物.该有机物可能是( )
A.CH≡C﹣CH3
B.![]()
C.CH2═CHCH3
D.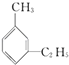
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com