
| A. | 我国发射的“嫦娥三号”卫星中使用的碳纤维,是一种新型无机非金属材料 | |
| B. | 只要符合限量,“食用色素”“碘元素”、“亚硝酸盐”可以作为某些食品的添加剂 | |
| C. | 氢氧化铁溶胶、水玻璃、淀粉溶液均具有丁达尔效应 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
分析 A.无机非金属材是以某些元素的氧化物、碳化物、氮化物、卤素化合物、硼化物以及硅酸盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料.是除有机高分子材料和金属材料以外的所有材料的统称;
B.“食用色素”、“碘元素”、“亚硝酸盐”都是食品添加剂.
C.丁达尔效应是胶体的特性;
D.地沟油属于油脂,油脂可发生皂化反应制肥皂;生物柴油是以动植物油脂、废餐饮用油等为原料与甲醇在催化剂作用下,进行酯交换制成的液体燃料.
解答 解:A.碳纤维是一种新型无机非金属材料,故A正确;
B.“食用色素”、“碘元素”、“亚硝酸盐”都是食品添加剂,注意适量添加,故B正确.
C.水玻璃是硅酸钠的水溶液,无丁达尔效应,故C错误;
D.地沟油经过皂化反应制肥皂,与甲醇在催化剂作用下进行酯交换制成生物柴油,故D正确;
故选C.
点评 本题考查化学与科学、技术、社会、环境等问题,题目难度不大,侧重对基础知识的巩固,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 在此反应中硝酸体现强氧化性,全部被还原 | |
| B. | 向反应后的溶液中再加入金属铁,不再发生化学反应 | |
| C. | 该反应中被还原的硝酸与未被还原的硝酸之比为1:4 | |
| D. | 该反应中被还原的硝酸与未被还原的硝酸之比为1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
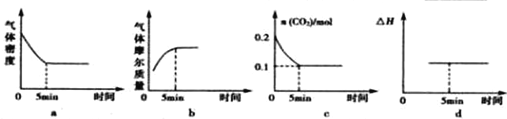
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 将二氧化硫通入到 一定量氯水中 | 将氨水滴入到一定量 氯化铝溶液中 | 将铜粉加入到一定量 浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
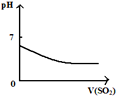 | 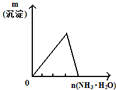 | 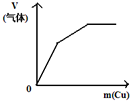 | 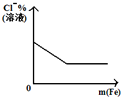 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素原子组成的化合物不可能是离子化合物 | |
| B. | ⅠA族元素的金属性一定比ⅡA族元素的金属性强 | |
| C. | 同一主族元素组成的化合物一定是共价化合物 | |
| D. | NH5中的所有原子的最外层都符合相应稀有气体原子电子层结构,1 mol NH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
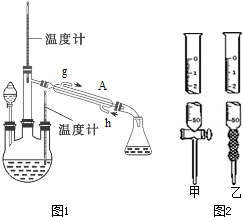
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝基苯、苯、乙醇三种液体 | B. | 硫酸钠、硝酸钾、氯化钡三种固体 | ||
| C. | 硫磺、过氧化钠、氯化钙三种固体 | D. | 氯化铝、偏铝酸钠、烧碱三种固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com