
| A、100mL 0.1 mol?L-1AlCl3溶液中,所含Al3+数为0.01NA |
| B、7gCnH2n中含氢原子数为NA |
| C、0.1mol?L-1氢氧化钠溶液中含钠离子数为0.1NA |
| D、5.6g铁与足量稀硫酸反应时失去电子数为0.3NA |


科目:高中化学 来源: 题型:
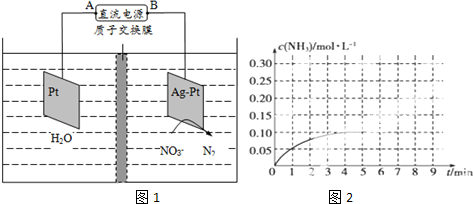
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S(s)在O2(g)中燃烧是放热反应 |
| B、S(g)+O2(g)=SO2(g)△H=bkJ?mol-1,则a<b |
| C、1mol SO2(g)所具有的能量低于1molS(s)与1molO2(g)所具有的能量和 |
| D、16g固体硫在空气中充分燃烧,可放出-a/2kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体和其他分散系的本质区别是胶体能产生丁达尔现象 |
| B、蒸发操作时,不能等到混合物中的水分完全蒸干后,才停止加热 |
| C、某样品在进行焰色反应时火焰颜色为黄色,则该样品中无钾元素 |
| D、萃取操作时,一定要选择密度比水大的萃取剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、所含共用电子对数目为(
| ||
| B、完全燃烧时消耗的氧气是33.6a/14L | ||
C、所含原子总数为
| ||
D、所含碳氢键数目为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24 L CCl4中含有的原子数为0.3NA |
| B、0.2mol/L的Fe2(SO4)3溶液中SO42-总数为0.6NA |
| C、5.6 g铁粉与硝酸完全反应失去的电子数一定为0.3NA |
| D、28 g N2和CO的混合气体含有的原子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 催化剂 |
| 1 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
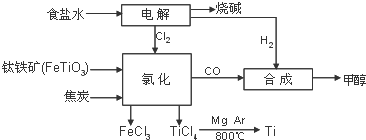 某化工厂将钛、氯碱工业和甲醇制备联合生产,大大提高原料利用率,并减少环境污染.流程如图:
某化工厂将钛、氯碱工业和甲醇制备联合生产,大大提高原料利用率,并减少环境污染.流程如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com