
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①③⑤⑥ |
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验现象 | 实验结论 | |
| A | 向未知液中滴加氯水,再滴加KSCN溶液 | 溶液呈红色 | 未知液中一定含有Fe2+ |
| B | 向无色溶液中滴加氯水,再加CCl4振荡,静置 | 溶液分层,下层呈紫红色 | 无色溶液中一定含I- |
| C | 某气体通入品红溶液中 | 红色褪去 | 该气体中一定含SO2 |
| D | 将豆粒大金属钾投入水中 | 钾熔化成小球,在水面上游动 | 金属钾密度一定小于水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
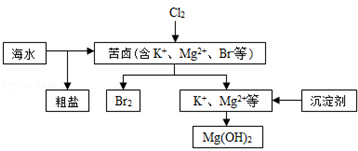
| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂、过滤、蒸发结晶等过程提纯 | |
| C. | 工业生产常选用NaOH作为沉淀剂 | |
| D. | 单质溴可用SO2将其还原吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑥ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
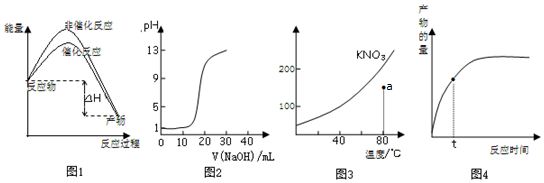
| A. | 图1表示加入催化剂不影响反应的焓变 | |
| B. | 图2表示用0.10mol/L CH3COOH溶液滴定20.00 mL0.10mol/LNaOH溶液所得到的滴定曲线 | |
| C. | 图3表示KNO3的溶解度曲线,图中点所示的溶液是80℃时KNO3的不饱和溶液 | |
| D. | 图4表示t时正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
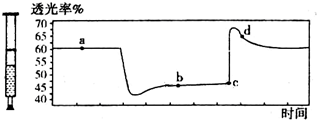 已知2NO2═N2O4+Q (Q>0),将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知2NO2═N2O4+Q (Q>0),将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | c点的操作是拉伸注射器 | |
| B. | b点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| C. | 若反应在一绝热容器中进行,则a、b两点的平衡常数Ka>Kb | |
| D. | d点:v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com