
| A. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液变红 | |
| B. | 只存在共价键的物质一定是共价化台物、离子化合物中一定含有离子键 | |
| C. | Na2O与Na2O2组成元素相同、阴阳离子个数比相同,但跟水反应的产物不同 | |
| D. | 元素原子的最外层电子数越多,得电子能力越强,失电子能力越弱 |
分析 A.新制氯水含有HClO,具有漂白性;
B.只存在共价键的物质可以是共价化合物或非金属单质;
C.Na2O与Na2O2跟水反应的产物不同,氧化钠与水反应生成氢氧化钠,过氧化钠与水反应生成氢氧化钠和氧气;
D.同主族元素原子的最外层电子数越多,失电子能力越强.
解答 解:A.新制氯水含有HClO,具有漂白性,向其中滴加少量紫色石蕊试液,溶液先变红后褪色,故A错误;
B.只存在共价键的物质可能是共价化台物,也可能是非金属单质,故B错误;
C.Na2O与Na2O2组成元素相同都只含有钠元素和氧元素、阴阳离子个数比相同都是2:1,氧化钠与水反应生成氢氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,故C正确;
D.同主族元素原子的最外层电子数越多,原子核对最外层电子的引力越小,所以失电子能力越强,得电子能力越弱,故D错误;
故选:C.
点评 本题为综合题,考查了氯水、氧化钠、过氧化钠的性质,物质所含化学键类型判断,原子结构与元素性质之间关系,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A}$(A-N+2m)mol | B. | $\frac{a}{A+m}$(A-N)mol | C. | $\frac{a}{A+m}$(A-N+2m)mol | D. | $\frac{a}{A+2m}$(A-N+m)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 混合物 | 除杂质的试剂 | 除杂质的方法 |
| 苯(苯酚) | NaOH溶液 | 分液 |
| 酒精(水) | 生石灰 | 蒸馏 |
| 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
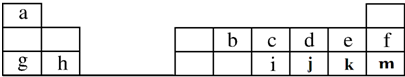
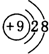 ,元素d与元素g形成的原子个数比为1:1的化合物的电子式为
,元素d与元素g形成的原子个数比为1:1的化合物的电子式为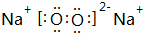 ;(用元素符号填空)
;(用元素符号填空)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO、NO均难溶于水 | |
| B. | CO、NO均为酸性氧化物 | |
| C. | CO、NO均为无色无味的有毒气体 | |
| D. | 在催化剂的作用下,可通过反应2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2来达到净化汽车尾气的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com