
 .
.分析 短周期的四种主族元素W、X、Y、Z,原子序数依次减小,W元素和Y元素的原子最外层上的电子数分别是各自电子层数的2倍,二者不可能同周期,则Y处于第二周期、W处于第三周期,故Y为C元素、W为S元素;四元素原子核外电子层数之和是8,则Z处于第一周期,X处于第二周期,可推知Z为H元素;X元素的原子最外层电子数等于Y和Z两元素的原子最外层电子数之和,即X原子最外层电子数为5,故X为N元素,能与H元素形成NH3,据此解答.
解答 解:短周期的四种主族元素W、X、Y、Z,原子序数依次减小,W元素和Y元素的原子最外层上的电子数分别是各自电子层数的2倍,二者不可能同周期,则Y处于第二周期、W处于第三周期,故Y为C元素、W为S元素;四元素原子核外电子层数之和是8,则Z处于第一周期,X处于第二周期,可推知Z为H元素;X元素的原子最外层电子数等于Y和Z两元素的原子最外层电子数之和,即X原子最外层电子数为5,故X为N元素,能与H元素形成NH3.
(1)由上述分析可知,W为S、X为N、Y为C、Z为H,故答案为:S;N;C;H;
(2)(NH4)2S属于离子化合物,其电子式为 ,
,
故答案为: ;
;
(3)A物质是一种酸,它的一个分子里含有一个S原子,一个N原子,一个C原子和一个H原子,四个原子共形成五对共用电子对,H形成1对、S形成2对、C形成4对、N形成3对,该物质的结构式为:H-S-C≡N,A物质的钾盐溶液常用检验Fe3+,故答案为:H-S-C≡N;Fe3+;
(4)已知S、N、C、H四种元素可两两组成多种微粒,其中所含电子数均为10的三种微粒:NH3、CH4、NH4+,故答案为:NH3、CH4、NH4+.
点评 本题考查结构性质位置关系,推断元素是解题的关键,注意根据W、Y的结构特点进行推断,侧重考查学生分析推理能力,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
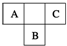 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等. ,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).
,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验装置设计. |  (注明所用试剂及气体流向) (注明所用试剂及气体流向) |
| 实验步驟及现象 | 连接好装置,将氯气通入亚硫酸钠溶液中,充分反应.取少量所得溶液与试管,滴入几滴氯化钡,有白色沉淀,再加入少量盐酸,沉淀不溶解. |
| 离子方程式 | Cl2+SO32-+H2O=2Cl-+SO42-+2H+; SO42-+Ba2+=BaSO4↓ |
| 结论 | Na2SO3具有还原性,能被氯气氧化成Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤④①③ | B. | ⑧④①②⑤③⑦ | C. | ⑧⑥②⑤④①③⑦ | D. | ⑧②④⑤①⑥③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有如下药品和装置:w克锌片(w<1g)、稀H2SO4、水,设计一个实验,测Zn的相对原子质量(假定实验是在标准状况下进行的).
现有如下药品和装置:w克锌片(w<1g)、稀H2SO4、水,设计一个实验,测Zn的相对原子质量(假定实验是在标准状况下进行的).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2与F2反应的热化学方程式为:H2(g)+F2(g)═2HF(g)△H=-541 kJ | |
| B. | 2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 | |
| C. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于541 kJ | |
| D. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )
如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )| A. | a为HCl,b为H2O | B. | a为CO2,b为浓NaOH溶液 | ||
| C. | a为Cl2,b为饱和NaCl溶液 | D. | a为NH3,b为浓NH4Cl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com